Reproducción y fertilidad: ¿cómo pueden ayudar la terapia génica y celular?
Para muchas personas que no pueden tener hijos biológicos debido a la ausencia o la calidad de sus óvulos o espermatozoides, noticias en los periódicos sobre científicos que crean espermatozoides u óvulos a partir de células madre en el laboratorio pueden parecer revolucionarias. Pero, ¿qué evidencia científica hay detrás de estos titulares y cuáles son las limitaciones para seguir avanzando? Esta ficha informativa resume los últimos avances en el tratamiento de la infertilidad y las enfermedades genéticas con óvulos y espermatozoides creados a partir de células madre.
¿Qué sabemos?
Las células madre tienen la capacidad de convertirse en diferentes tipos de células cuando reciben las instrucciones adecuadas. Algunas células madre pueden producir cualquier tipo de célula del cuerpo. Éstas son las denomina nadas pluripotentes.
Las células madre pluripotentes pueden obtenerse de embriones de cinco días, antes de que el embrión se implante en el útero. Estas células (denominadas células madre embrionarias o CME) pueden cultivarse en el laboratorio en grandes cantidades, conservando su capacidad de convertirse en otros tipos de células.
Las células madre pluripotentes también pueden crearse «reprogramando» otras células del cuerpo en el laboratorio, como las células de la piel. A este tipo de células madrese las conoce como células madre pluripotentes inducidas o iPSC.
Las iPSC son de especial interés para su uso en posibles tratamientos de fertilidad ya que los científicos podrían utilizarlas para producir espermatozoides y óvulos (denominados gametos) para procesos de fecundación in vitro. A la creación de espermatozoides y óvulos en el laboratorio se la denomina gametogénesis in vitro o IVG.
Aunque se ha logrado producir ratones con óvulos y espermatozoides generados a partir de células madre y IVG, aún no se ha conseguido crear seres humanos.
¿En qué están trabajando los investigadores?
Las investigaciones en curso se centran en varios aspectos de la IVG.
- Algunos grupos están desarrollando nuevos métodos para crear células precursoras de óvulos y espermatozoides (células germinales primordiales o PGC) a partir de células madre pluripotentes humanas, para luego desarrollar espermatozoides u óvulos a partir de ellas.
- Otros grupos están tratando de crear un entorno propicio en el que estas células precursoras puedan desarrollarse en espermatozoides u óvulos en el laboratorio, lo que significa recrear testículos u ovarios en desarrollo. Esto implica dirigir las células madre para que se conviertan en otros tipos de células de los testículos (como las células de Sertoli, que participan en el desarrollo de las PGC, o las células de Leydig, que producen testosterona) o de los ovarios (como las células de la granulosa, que participan en el desarrollo de óvulos).
- stos métodos también se están utilizando para comprender las afecciones que alteran el desarrollo testicular u ovárico, lo que a su vez afecta a la fertilidad o a las características sexuales. Este tipo de investigación se denomina modelización de enfermedades. Puede incluir la identification de los genes necesarios para las diferentes etapas de la formación de ovarios y testículos funcionales, así como de óvulos y espermatozoides.
¿Cuáles son los retos?
La producción de óvulos y espermatozoides a partir de otros tipos de células adultas mediante la IVG podría tener amplias aplicaciones para las personas afectadas por infertilidad o transmisión de enfermedades genéticas. Sin embargo, en la actualidad existen cuatro obstáculos principales para la aplicación de las tecnologías de IVG en seres humanos:
- La obtención de suficiente cantidad de células precursoras de óvulos y espermatozoides (PGC) viables a partir de células madre.
- Asegurarse de que estas PGC humanas producen óvulos y espermatozoides pero no generan tumores, el cual es un riesgo asociado al uso de células pluripotentes.
- Averiguar cómo madurar las PGC humanas en óvulos y espermatozoides totalmente funcionales en el laboratorio para poder evitar el trasplante de PGC inmaduras a personas. Esto eliminaría procedimientos invasivos y evitaría el riesgo de formación de tumores.
- Establecer cómo evaluar la capacidad de los espermatozoides y óvulos generados en laboratorio para crear embriones y niños sanos, dadas las restricciones actuales en muchos países sobre la creación de embriones para la investigación o su cultivo en el laboratorio más allá de ciertos puntos de desarrollo.
Además de superar las barreras científicas, los próximos pasos también deben incluir la consideración de las importantes barreras sociales, éticas y legales que existen para el uso de la IVG. La legislación que regula el uso y la creación de embriones varía en todo el mundo. Si las tecnologías de IVG se vuelven científicamente viables, será necesario modificar la legislación para permitir su aplicación clínica.
Introducción a las tecnologías de reproducción asistida
Las técnicas de reproducción asistida (TRA) son tecnologías que ayudan a parejas o personas a lograr un embarazo sin relaciones sexuales. Esto implica la manipulación de espermatozoides, óvulos o embriones fuera del cuerpo. Los procedimientos de TRA incluyen el uso de la fecundación in vitro (FIV), en la que se crean embriones en el laboratorio antes de transferirlos al útero de una madre potencial o de una madre subrogada. Las TRA también pueden implicar el uso de gametos donados (espermatozoides u óvulos) o embriones fecundados.
Las TRA pueden utilizarse por diversas razones:
- Infertilidad: La Organización Mundial de la Salud informa de que uno de cada seis adultos sufre infertilidad y, por lo tanto, puede que sea incapaz de concebir. La infertilidad puede estar causada por una serie de afecciones y factores, y puede afectar a cualquier persona.
- Uso de gametos de donantes: Las personas que sufren infertilidad, las parejas del mismo sexo o las personas que desean concebir y ser progenitores en solitario pueden optar por concebir utilizando gametos donados por otra persona.
- Riesgos genéticos conocidos: Si uno o ambos progenitores sabe que son portadores de una enfermedad genética que acorta la esperanza de vida, pueden optar por concebir mediante FIV y someterse a pruebas genéticas preimplantacionales. Este proceso permite seleccionar los embriones que no son portadores de la mutación genética para su implantación con el fin de evitar que la enfermedad genética específica de los progenitores se transmita al niño.
Tratamientos y apoyo actuales
Para las personas o parejas con baja fertilidad o que no pueden concebir, las TRA, incluida la fecundación in vitro (FIV), permiten la fecundación de óvulos con espermatozoides en el laboratorio. Primero, se extraen óvulos maduros de los ovarios, lo que implica el uso de medicamentos que suprimen el ciclo menstrual natural y combinaciones de hormonas para ayudar a estimular la maduración de los óvulos. A continuación, los óvulos recolectados se fecundan con espermatozoides en el laboratorio.
Los embriones resultantes se cultivan durante un máximo de 6 días y se evalúa su desarrollo. En este punto, si alguno de los progenitores es portador de una enfermedad genética que acorta la esperanza de vida, pueden optar por realizar pruebas genéticas previas a la implantación, que permiten examinar los genes del embrión en el laboratorio. Así,los embriones que no presentan la mutación que causa la enfermedad son identificados para que ésta no se transmita al niño. A continuación, los embriones pueden transferirse al útero de la madre biológica o de la madre subrogada, o bien congelarse y almacenarse para su uso futuro.
Sin embargo, para que las tecnologías de TRA actuales den lugar a un embrión biológicamente relacionado, es necesario que al menos uno de los progenitores tenga gametos viables.
A las personas y parejas que carecen de espermatozoides u óvulos adecuados se les puede ofrecer gametos o embriones de donantes. Esto significaría que el niño no tendría relación genética con uno o ambos progenitores. El acceso a gametos o embriones de donantes puede ser difícil debido a las limitaciones y restricciones que rodean a la donación, así como al número limitado de donantes.
Actualmente, otras opciones adicionales a la TRA son la adopción y la decisión de no tener hijos.
How might gene and cell therapies help?
Para crear un embrión biológicamente relacionado, las TRA existentes requieren que al menos uno de los progenitores tenga óvulos o espermatozoides sanos y funcionales. Sin embargo, los investigadores están estudiando cómo producir óvulos y espermatozoides sanos a partir de células madre en el laboratorio (lo que se denomina gametogénesis in vitro o IVG), algo que aún no se ha logrado en seres humanos.
Hay varias razones por las que una persona o una pareja podrían beneficiarse de la IVG:
- Cuando las TRA existentes no han tenido éxito.
- Cuando las TRA existentes no son adecuadas debido a la falta de ovarios/testículos, óvulos/espermatozoides o ainfertilidad como consecuencia de la edad o de tratamientos contra el cáncer.
- Cuando se sabe que las parejas son portadoras de enfermedades genéticas y desean crear un grupo más amplio de embriones entre los que elegir.
- Para evitar los riesgos y las cargas de las TRA existentes, que pueden incluir inyecciones hormonales, un seguimiento muy exhaustivo y la extracción de óvulos.
- Para parejas del mismo sexo que solo producen óvulos o espermatozoides de forma natural.
- Para personas solteras que son infértiles y desean crear un óvulo o espermatozoide a partir de sus propias células madre para ser fecundados por un donante.
- Para personas solteras que desean utilizar su propio óvulo o espermatozoide natural con un óvulo o espermatozoide derivado de sus propias células madre, lo que les permite ser los únicos progenitores genéticos.
How could stem cells be used to help reproductive issues?
¿Qué son las células madre pluripotentes?
Las células madre pluripotentes son células que pueden convertirse en cualquier otro tipo de célula del cuerpo. Durante el desarrollo embrionario, poblaciones de células madre maduran y se convierten en diferentes tipos de células, perdiendo su pluripotencia. Sin embargo, existen métodos para «reprogramar» una célula madura y devolverla a su estado pluripotente, y estas células pluripotentes (iPSC) pueden producir cualquier tipo de célula del cuerpo.
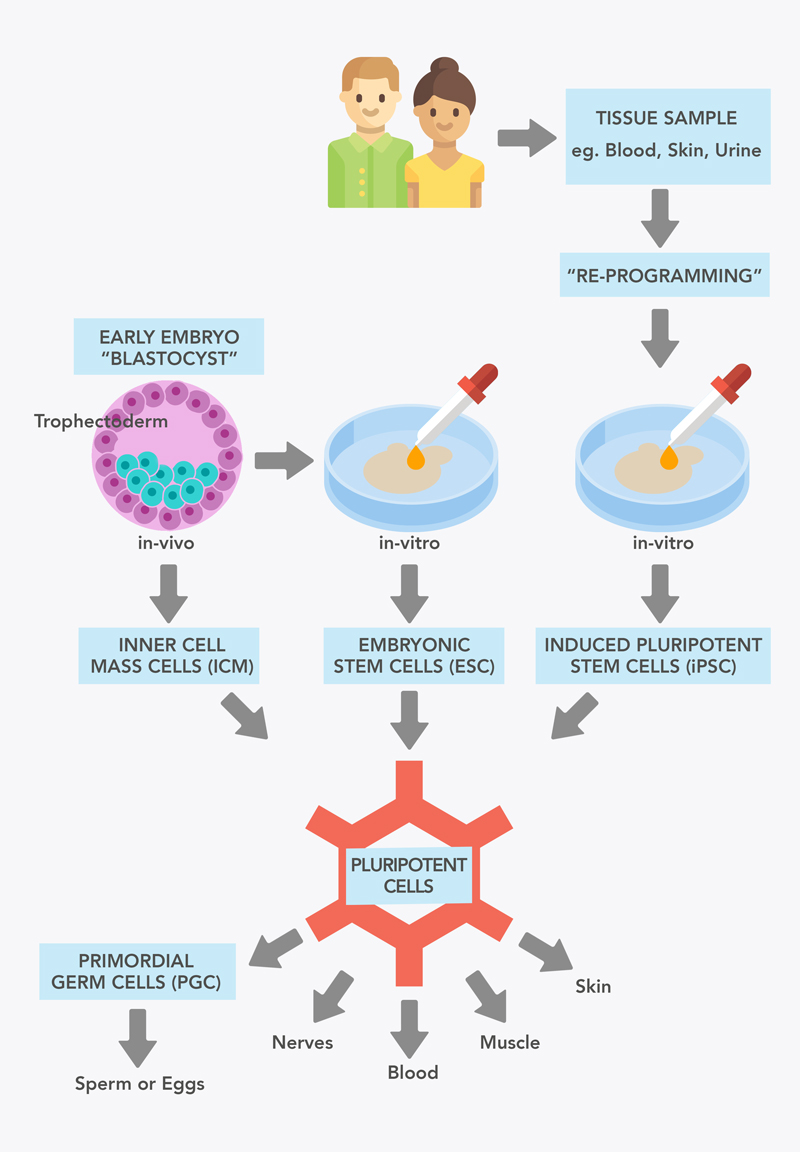
Figure 1: Sources of pluripotent stem cells.
Se puede obtener un tipo de célula madre pluripotente de embriones en fases muy tempranas del desarrollo. A los cinco días, el embrión se denomina blastocisto. Éste está formado por una capa externa de células llamada trofoblasto y una capa interna llamada masa celular interna (ICM). Las células de la ICM son pluripotentes, pero pierden su pluripotencia al desarrollar otras células y tejidos embrionarios tras la implantación en el útero.
When ICM pluripotent cells are grown outside the embryo in the lab, they are known as embryonic stem cells (ESC). ESC were the first population of pluripotent stem cells (PSC) available to researchers, first derived from human embryos in 1998.
Cuando las células pluripotentes de la MCI se cultivan fuera del embrión en el laboratorio, se denominan células madre embrionarias (CME). Las CME fueron el primer tipo de células madre pluripotentes (CMP) disponibles para los investigadores. Se obtuvieron por primera vez a partir de embriones humanos en 1998.
En niños o adultos no existen fuentes bien establecidas de células madre pluripotentes ya que la mayoría de ellas ya se han comprometido con un destino celular y han perdido, por tanto, su pluripotencia. En 2006, el investigador Shinya Yamanaka demostró que las células de la piel de ratones también podían convertirse en células madre pluripotentes. A este proceso es conocidocomo reprogramación. Las células resultantes tras la reprogramación se asemejaban a las células madre embrionarias por lo que las denominó células madre pluripotentes inducidas (iPSC). Al igual que las células madre embrionarias, estas células tienen el potencial de formar todos los tipos de células del cuerpo, incluidos los óvulos y los espermatozoides. Pronto se demostró que esta tecnología también funcionaba con células humanas. La generación de iPSC supuso una revolución en el campo de las células madre y en la medicina en general, y fue galardonada con el Premio Nobel en 2012, solo cinco años después de que la tecnología se aplicara a células humanas. En la actualidad, se ha conseguido crear iPSC a partir de muchos tipos de células, incluidas células de la piel, células sanguíneas e incluso células recogidas de la orina.
Uso de células madre pluripotentes para producir espermatozoides y óvulos sanos
Las células madre pluripotentes se han usado en ratones para producir espermatozoides y óvulos a partir de células de ratón. No se ha conseguidoproducir óvulos ni espermatozoides a partir de células madre pluripotentes humanas, aunque se ha logrado cierto éxito en la producción de las células precursoras (células germinales primordiales, PGC).
Los investigadores japoneses Katsuhiko Hayashi y Mitinori Saitou fueron pioneros en la tecnología de gametogénesis in vitro (IVG) utilizando modelos animales. En 2011, demostraron que las CMP de ratones podían reprogramarse para convertirse en espermatozoides capaces de dar lugar a crías sanas y fértiles. Al año siguiente, demostraron que las CMP de ratones hembra podían convertirse en óvulos con la misma capacidad.
Varios factores fueron fundamentales para su éxito:
- El tipo de célula de partida: tras la implantación del embrión, la masa celular interna (ICM) se convierte en células del epiblasto. Algunas de estas células del epiblasto salen del embrión en desarrollo y se convierten en células germinales primordiales (PGC). Posteriormente, estas PGC migran de nuevo al feto y se alojan en los ovarios o testículos en formación, donde se convierten en óvulos o espermatozoides. Algunos investigadores han estudiado cómo producir células similares a estas células del epiblasto. Sin embargo, Hayashi y sus colegas demostraron que estas células no eran muy eficaces para producir PGC. En su lugar, desarrollaron un nuevo tipo de célula del epiblasto a partir de CME de ratón: la célula epiblastoide. Este tipo de célula tiene más éxito a la hora de convertirse en PGC y, posteriormente, en óvulos y espermatozoides.
- Pureza del tipo celular: Es difícil conseguir que todas las células madre pluripotentes respondan exactamente de la misma manera cuando son manipuladas para producir tipos específicos de células. . Esto puede resultar en una población mixta de células, incluyendo tipos que no son necesariamente deseables o células que conservan la pluripotencia y no logran formar óvulos y espermatozoides. Además, estas últimas pueden formar tumores. Por lo tanto, la purificación de las PGC es fundamental para eliminartipos de células no deseadas, algo que estosestudios también consiguieron.
- Requerimiento de maduración in vivo: El proceso de producción de óvulos y espermatozoides funcionales y maduros en estos estudios requirió el trasplante de las células similares a las PGC en ovarios o testículos de ratones. Ahí se consigue convertirlas en óvulos y espermatozoides maduros, algo que en aquel momento no era posible en el laboratorio. Por ello, es importante descubrir cómo el ovario o el testículo favorece esta maduraciónpara poder recrear estas condiciones en el laboratorio, eliminando la necesidad de uso de testículos y ovarios funcionales o deprocedimientos invasivos y arriesgados.
Más investigaciones se han seguido realizando para mejorar esta tecnología. En 2016, Saitou y Hayashi consiguieron obtener óvulos maduros de ratón en una placa de petri a partir de CME y iPSC, sin necesidad de volver a introducir las células en ovarios de ratones para su maduración. Sin embargo, seguían necesitando tejido obtenido de ovarios de ratones para favorecer el desarrollo de los óvulos.
Recientemente, el laboratorio de Hayashi ha superado la necesidad de utilizar tejido ovárico de ratones gracias a la creación de células de soporte ovárico a partir de células madre. Estas células fueron capaces de promover el desarrollo de células similares a las PGC derivadas de células madre hasta convertirse en óvulos viables, que podían ser fecundados y producir embriones viables.
De manera similar, el trabajo del laboratorio de Zhou en China demostró la creación de células similares a precursoras de espermatozoides a partir de CME de ratón sin necesidad de tejido testicular, lo que permitió por primera vez la IVG completa sin necesidad de tejido de un modelo animal.
¿Y en los seres humanos?
Algunos investigadores han intentado reproducir estos hallazgos utilizando células humanas, pero hasta ahora no han logrado crear espermatozoides u óvulos funcionales a partir de células madre humanas. Todavía existen lagunas en nuestro conocimiento sobre el desarrollo embrionario humano natural. Desde el primer éxito en la creación de células similares a las PGC a partir de células madre humanas in vitro, varios grupos de investigación han desarrollado métodos más eficaces o perfeccionados para producir precursores de gametos. Sin embargo, madurar estos precursores hasta convertirlos en óvulos y espermatozoides funcionales sigue siendo un reto.
En 2018, Yamashiro y sus colegas crearon células que se asemejan a los óvulos humanos tempranos a partir de iPSC. Sin embargo, para ello tuvieron que utilizar tejido ovárico de ratón para favorecer su obtención. De manera similar, en 2021, Hwang y sus colegas obuvieron células precursoras de espermatozoides humanos a partir de iPSC, pero también tuvieron que recurrir a células testiculares de ratón para promover su desarrollo.
¿Cómo se podrían evitar las enfermedades genéticas con óvulos y espermatozoides derivados de células madre pluripotentes?
Pruebas genéticas previas a la implantación
Tras la fecundación de embriones en la clínica para realizar FIV, se cultivan durante varios días hasta que alcanzan la fase de blastocisto, que consiste en la masa celular interna y el trofoectodermo que la rodea. El trofectodermo son las células que dan lugar a las estructuras de soporte, como la placenta y las membranas amnióticas durante el embarazo. En esta fase, los progenitores pueden optar por la realización de PGT.
Se extraen 4-5 células del trofoectodermo. Estas células se secuencian genéticamente para detectar si el embrión es portador de la variante genética de la enfermedad. Una vez identificados los embriones que no son portadores, éstos pueden transferirse al útero de la madre biológica o subrogada o congelarse para su uso futuro. Esta estrategia reduce el número de embriones que puede utilizar una pareja y, por lo tanto, puede requerir un mayor número de embriones iniciales. En algunos casos, se necesitan varias rondas de FIV antes de lograr un embarazo con un embrión que no sea portador de las variantes genéticas no deseadas. No es posible realizar pruebas genéticas a los óvulos y los espermatozoides antes de la fecundación, ya que el análisis del ADN de las células con las técnicas actuales destruiría la célula.
Una estrategia alternativa sería el uso de edición genética para corregir mutaciones en embriones, en lugar de seleccionar aquellos que no presentan mutaciones. Sin embargo, existen importantes consideraciones técnicas y éticas que lo impiden. La tecnología actual de edición genética puede afectar a partes no deseadas del ADN, provocando efectos secundarios no deseados. También sería difícil corregir la mutación en todas las células del embrión, lo que daría lugar a que algunas células portaran la mutación y pudieran afectar a la salud de la progenie..
La edición genética de células madre pluripotentes es una tecnología bien establecida y que podría, por tanto, ser una alternativa al intento de editar los genes del embrión. Las células en que dicho proceso es exitoso podrían usarse para obtener óvulos o espermatozoides y producir embriones. Además, dado que las células madre pueden cultivarse fácilmente en grandes cantidades, se podría producir un número mayor de gametos que el que se recoge normalmente en un ciclo de fecundación in vitro. A continuación, se presentan algunos ejemplos de cómo se podría evitar la herencia de enfermedades genéticas.
- Edición genética con CRISPR/Cas9: permite alterar la secuencia de ADN de las células madre. Esto podría añadir una sección inexistente, eliminar una sección que codifica un gen asociado a enfermedad o corregir una variante de un gen defectuoso para que codifique un gen sano. A continuación, se seleccionarían y cultivarían las células corregidas. Esto significaría que al ADN de todos los óvulos y espermatozoides resultantes de estas células madre corregidas no serían portadores de la enfermedad. También se podrían detectar mutaciones no deseadas colaterales y asociadas a la técnica antes de la producción de óvulos y espermatozoides.
- Selección: En el caso de las enfermedades causadas por mosaicismo (enfermedades en las que se encuentra un cambio genético solo en algunas células), se podrían identificar y aislar células madre pluripotentes individuales que no portaran la variación causante de la enfermedad. Éstas serían las células que se cultivarían para la producción de óvulos y espermatozoides.
- Eliminación de cromosomas adicionales: algunas afecciones que afectan a la fertilidad están causadas por la aneuploidía cromosómica, es decir, la presencia de un número anómalo de cromosomas en los gametos. En este caso, las células madre también podrían utilizarse para producir gametos sin aneuploidía. En ratones, los científicos han eliminado con éxito cromosomas adicionales de células pluripotentes y los han utilizado para producir crías sanas con éxito. Otros estudios han conseguido alterar el número de cromosomas en modelos de células iPSC humanas para evitar el síndrome de Down (trisomía 21, en la que un cromosoma 21 adicional provoca una serie de problemas, entre ellos la infertilidad) y el síndrome de Klinefelter (en el que los individuos tienen cromosomas XXY). Esto podría aplicarse a otros trastornos humanos causados por la presencia de cromosomas adicionales. Tecnologías similares podrían utilizarse potencialmente en personas que producen óvulos o espermatozoides con adición o eliminación esporádica de cromosomas, un fenómeno que aumenta con la edad.
Próximos pasos
Actualmente, hay cuatro obstáculos importantes que superar antes de poder aplicar los procesos desarrollados en ratones en humanos:
- Producir un gran número de PGC sin utilizar tejidos fetales para mediar el proceso.
- Asegurarse de que estas PGC humanas producen óvulos y espermatozoides pero no tumores, desarrollando métodos para eliminar las células madre indiferenciadas.
- Descubrir cómo madurar las PGC humanas hasta convertirse en óvulos y espermatozoides en el laboratorio para evitar el trasplante a personas y sin necesidad de tejidos animales o humanos para sustentar este proceso. Esto evitaría tanto la necesidad de un procedimiento invasivo como el riesgo de tumores.
- Demostrar la seguridad y viabilidad a largo plazo del esperma y los óvulos producidos por IVG. Esto supone un reto, dadas las restricciones actuales para crear embriones humanos o cultivarlos en el laboratorio más allá de ciertos puntos de desarrollo.
En 2015, un estudio británico en humanos logró producir PGC con bastante eficacia, sin tejidos de sustento; alrededor del 40 % de las células se convirtieron en células similares a las PGC. También creen haber encontrado una forma fiable de purificar esta población de células para evitar tumores. Este estudio supone un gran avance hacia la resolución de las barreras 1 y 2. Sin embargo, no se ha trascendido que se estéi intentando madurar o trasplantar estas células.
Otros laboratorios están trabajando en la creación de las células somáticas de sustento de los testículos o los ovarios, e incluso en la creación de réplicas tridimensionales in vitro de tejido ovárico o testicular (denominadas organoides) derivadas íntegramente de células madre. Esto podría ser necesario para producir gametos totalmente funcionales in vitro, y también podría utilizarse para muchas otras aplicaciones de la medicina reproductiva, como la selección de fármacos, la modelización de enfermedades y estudios de toxicidad de contaminantes ambientales.
Abordaje de retos jurídicos, éticos y sociales
Además de superar las barreras científicas, los próximos pasos también deben incluir la consideración de importantes barreras sociales, éticas y jurídicas. La legislación que regula el uso y la creación de embriones varía en todo el mundo. Ésta,,a menudo refleja la cultura y las normas sociales propias de cada país, así como la legislación vigente en ámbitos similares de la investigación y la medicina. Si las tecnologías de IVG se vuelven científicamente viables, será necesario modificar la legislación para permitir su aplicación clínica. Es probable que cualquier reforma normativa se vea influida por la opinión de la comunidad sobre la IVG y las tecnologías reproductivas. Concretamente, el se requerirá el abordaje de cuestiones éticas fundamentales como quién debe poder utilizar estas tecnologías, cómo se garantizará un acceso equitativo a las mismas y, lo que es más importante, qué medidas de apoyo se pondrán en marcha para supervisar adecuadamente la salud de los bebés nacidos a partir de estas tecnologías a largo plazo.
¿Podríamos producir óvulos a partir de células madre masculinas o espermatozoides a partir de células madre femeninas en un laboratorio?
Actualmente no hay pruebas de que la IVG en seres humanos pueda utilizarse para crear espermatozoides a partir de células madre femeninas u óvulos a partir de células madre masculinas. Sin embargo, algunas investigaciones con ratones evidencian que esto podría ser posible.
What evidence do we have for or against this being possible?
Pruebas de la producción de óvulos a partir de células madre pluripotentes XY (masculinas) o de esperma a partir de células madre pluripotentes XX (femeninas):
En 2018, Li y sus colegas crearon ratones vivos con dos madres (bimaternos) y ratones vivos con dos padres (bipaternos). Sin embargo, los ratones bipaternos murieron poco después de nacer.
En 2023, Murakami y sus colegas lograron convertir células madre XY (masculinas) en células madre XX (femeninas). Estas células madre XY --> XX produjeron óvulos maduros y funcionales con la misma eficacia que las células madre XX naturales. Cuando se fertilizaron, estos óvulos produjeron descendencia viva, lo que proporcionó pruebas de que la reproducción bipaterna en ratones parece ser posible.
Evidencia en contra de la producción de óvulos a partir de células XY (masculinas) o de espermatozoides a partir de células XX (femeninas):
Aunque el artículo de Murakami y colaboradores de 2023 indica que esto podría ser posible, décadas de investigación previa sobre la formación de gametos y la selección del sexo en mamíferos cuestionaban la viabilidad de formar óvulos a partir de células con cromosomas XY, o espermatozoides a partir de células sin ellos (revisado en Taketo 2015). Estos estudios previos sostienen que la producción de espermatozoides a partir de células XX (femeninas) o de óvulos a partir de células XY (masculinas) no era posible. Además, la barrera para el desarrollo de individuos sanos se observa en las aneuploidías de los cromosomas sexuales humanos asociadas a la esterilidad, entre las que se incluyen:
- Mujeres XY: síndrome de Swyer
- Hombres XX: síndrome de De la Chapelle
- Hombres XXY: síndrome de Klinefelter
- Mujeres XO: síndrome de Turner
Es importante señalar que la mayoría de estos estudios se centran en condiciones en las que tanto los óvulos o espermatozoides como el entorno que los rodea (ovarios o testículos) presentan disfunciones genéticas. Aún no se han realizado experimentos en los que se introduzcan PGC XY sanos en un ovario XX sano, o PGC XX sanos en un testículo XY sano. Sin embargo, estos experimentos serían teóricamente posibles utilizando los métodos de Hayashi mencionados anteriormente.
Serían necesarias más investigación para ver si el trabajo de Murakami y colaboradores puede repetirse de forma fiable.
