Pour de nombreuses personnes qui ne peuvent pas avoir d'enfant biologiquement lié à elles en raison de l'absence ou de la qualité de leurs ovules ou de leur sperme, les articles de journaux sur des scientifiques qui fabriquent du sperme ou des ovules à partir de cellules souches en laboratoire peuvent sembler révolutionnaires. Mais quelle est la science derrière ces gros titres, et quelles sont les limites à l'avancement de cette technologie ? Cette fiche d'information résume les avancées récentes dans le traitement de l'infertilité et des maladies génétiques à l'aide d'ovules et de spermatozoïdes créés à partir de cellules souches.
Que savons-nous ?
Les cellules souches ont la capacité de se différencier en différents types de cellules lorsqu'elles reçoivent les instructions appropriées. Certaines cellules souches peuvent produire n'importe quel type de cellule du corps. On les appelle alors « pluripotentes ».
Les cellules souches pluripotentes peuvent être prélevées sur des embryons de cinq jours, avant leur implantation dans l'utérus. Ces cellules (appelées cellules souches embryonnaires ou CSE) peuvent être cultivées en grand nombre en laboratoire, tout en conservant leur capacité à se développer en d'autres types de cellules.
Les cellules souches pluripotentes peuvent également être créées en « reprogrammant » d'autres cellules du corps en laboratoire, telles que les cellules de la peau (appelées cellules souches pluripotentes induites ou iPS).
Ces cellules souches présentent un intérêt particulier pour d'éventuels traitements de fertilité, car les scientifiques pourraient être en mesure d'utiliser des cellules souches pluripotentes pour fabriquer des spermatozoïdes et des ovules (appelés collectivement « gamètes ») destinés à la fécondation in vitro. Le processus de création de spermatozoïdes et d'ovules en laboratoire est appelé « gamétogenèse in vitro » ou « IVG ».
Si des souris ont été créées à partir d'ovules et de spermatozoïdes générés à partir de cellules souches et de l'IVG, cela n'a pas encore été réalisé chez l'être humain.
Sur quoi travaillent les chercheurs ?
Les recherches en cours portent sur plusieurs aspects de l'IVG.
- Certains groupes mettent au point de nouvelles méthodes pour créer des cellules précurseurs d'ovules et de spermatozoïdes (cellules germinales primordiales, ou CGP) à partir de cellules souches pluripotentes humaines, puis cherchent à déterminer comment les diriger pour qu'elles se développent en spermatozoïdes ou en ovules.
- D'autres groupes tentent de créer un environnement favorable au développement de ces cellules précurseurs en spermatozoïdes ou en ovules en laboratoire, ce qui implique de recréer les testicules ou les ovaires en développement. Cela consiste à orienter les cellules souches vers d'autres types de cellules des testicules (telles que les cellules de Sertoli, qui favorisent le développement des PGC, ou les cellules de Leydig, qui produisent la testostérone) ou des ovaires (telles que les cellules de la granulosa, qui favorisent le développement des ovules).
- Ces méthodes sont également utilisées pour comprendre les conditions dans lesquelles le développement des testicules ou des ovaires est perturbé, ce qui affecte à son tour la fertilité ou les caractéristiques sexuelles. Ce type de recherche est appelé « modélisation de maladies ». Il peut inclure l'étude des gènes nécessaires aux différentes étapes de la formation d'ovaires et de testicules fonctionnels, ainsi que d'ovules et de spermatozoïdes.
Quels sont les défis à relever ?
Si les ovules et les spermatozoïdes pouvaient être produits à partir d'autres types de cellules adultes grâce à l'IVG, cela pourrait avoir de nombreuses applications pour les personnes touchées par l'infertilité ou le risque de transmission de maladies génétiques. Cependant, quatre obstacles majeurs empêchent actuellement l'application des technologies d'IVG chez l'être humain :
- Produire en quantité suffisante des cellules précurseurs d'ovules et de spermatozoïdes (PGC) viables à partir de cellules souches.
- S'assurer que ces PGC humaines produisent des ovules et du sperme, mais ne génèrent pas de tumeurs, ce qui peut être un risque pour les cellules pluripotentes.
- Déterminer comment faire mûrir les PGC humaines en ovules et spermatozoïdes pleinement fonctionnels en laboratoire, afin d'éviter de transplanter des PGC immatures chez l'être humain. Cela permettrait d'éliminer les procédures invasives et de prévenir le risque de formation de tumeurs.
- Déterminer comment tester la capacité des spermatozoïdes et des ovules produits en laboratoire à créer des embryons et des enfants en bonne santé, compte tenu des restrictions actuellement en vigueur dans de nombreux pays concernant la création d'embryons à des fins de recherche ou leur développement en laboratoire au-delà de certains stades de développement.
Outre la levée des obstacles scientifiques, les prochaines étapes doivent également tenir compte des obstacles sociaux, éthiques et juridiques importants qui s'opposent à l'utilisation de l'IVG. La législation régissant l'utilisation et la création d'embryons varie d'un pays à l'autre. Si les technologies d'IVG deviennent scientifiquement viables, la législation devra être modifiée pour permettre leur application clinique.
Introduction aux technologies d'aide à la reproduction
Les technologies d'aide à la reproduction (ART) sont des technologies qui aident les couples ou les individus à obtenir une grossesse sans rapport sexuel. Elles impliquent la manipulation de spermatozoïdes, d'ovules ou d'embryons en dehors du corps. Les procédures de TAR comprennent le recours à la fécondation in vitro (FIV), où les embryons sont créés en laboratoire avant d'être transférés dans l'utérus d'une mère potentielle ou d'une mère porteuse. Les ART peuvent également impliquer l'utilisation de gamètes (spermatozoïdes ou ovules) ou d'embryons fécondés provenant de donneurs.
Les ART peuvent être utilisées pour diverses raisons :
- Infertilité : L'Organisation mondiale de la santé rapporte qu'un adulte sur six est infertile et peut donc être incapable de concevoir un enfant. L'infertilité peut être causée par toute une série de conditions et de facteurs et peut toucher n'importe qui.
- Recours à des gamètes de donneurs : les personnes infertiles, les couples de même sexe ou les personnes qui souhaitent concevoir et élever un enfant seules peuvent choisir de recourir à des gamètes provenant d'un donneur.
- Risques génétiques connus : si l'un des parents ou les deux savent qu'ils sont porteurs d'une maladie génétique mortelle, ils peuvent choisir de concevoir par FIV et de subir un test génétique préimplantatoire. Ce processus permet de sélectionner les embryons qui ne sont pas porteurs de la mutation génétique afin d'éviter que la maladie génétique spécifique du parent ne soit transmise à l'enfant.
Traitements et soutien actuels
Pour les personnes ou les couples qui ont une faible fertilité ou qui ne peuvent pas concevoir, les techniques de procréation assistée, notamment la fécondation in vitro (FIV), permettent de féconder des ovules avec du sperme en laboratoire. Les ovules matures sont prélevés dans les ovaires, ce qui nécessite des médicaments qui suppriment le cycle menstruel naturel et des combinaisons d'hormones pour aider à stimuler la maturation des ovules. Les ovules sont ensuite prélevés et fécondés avec du sperme en laboratoire.
Les embryons obtenus sont cultivés pendant 6 jours maximum et leur développement est évalué. À ce stade, si l'un des parents est porteur d'une maladie génétique limitant l'espérance de vie, il peut opter pour un test génétique préimplantatoire, qui permet de dépister les gènes de l'embryon en laboratoire. Les embryons ne présentant pas la mutation responsable de la maladie sont identifiés, afin que celle-ci ne soit pas transmise à l'enfant. Les embryons peuvent ensuite être transférés dans l'utérus de la mère d'intention ou de la mère porteuse, ou congelés et conservés pour une utilisation future.
Cependant, pour que les technologies de PMA actuelles permettent d'obtenir un embryon biologiquement apparenté, au moins l'un des parents doit avoir des gamètes viables.
Pour les personnes et les couples qui ne disposent pas de spermatozoïdes ou d'ovules appropriés, il est possible de recourir à des gamètes ou à des embryons provenant de donneurs. Cela signifie que l'enfant qui naîtra ne sera pas génétiquement lié à l'un ou aux deux parents d'intention. L'accès aux gamètes ou aux embryons provenant de donneurs peut être difficile en raison des limitations et des restrictions qui entourent le don, ainsi que du nombre limité de donneurs.
Actuellement, les autres options non liées à la PMA sont l'adoption et le choix de ne pas avoir d'enfants.
Comment les thérapies géniques et cellulaires peuvent-elles aider ?
Pour créer un embryon biologiquement apparenté, les techniques de procréation assistée existantes exigent qu'au moins un des parents ait des ovules ou des spermatozoïdes sains et fonctionnels. Cependant, les chercheurs étudient actuellement la possibilité de produire des ovules et des spermatozoïdes sains à partir de cellules souches en laboratoire (ce que l'on appelle la « gamétogenèse in vitro » ou IVG), mais cela n'a pas encore été réalisé chez l'être humain.
Il existe plusieurs raisons pour lesquelles une personne ou un couple pourrait potentiellement bénéficier d'une IVG :
- Lorsque les techniques de procréation assistée existantes ont échoué.
- Lorsque les techniques de PMA existantes ne sont pas adaptées en raison de l'absence d'ovaires/testicules, d'ovules/spermatozoïdes ou d'une infertilité due à l'âge ou à un traitement contre le cancer.
- Lorsque les couples sont porteurs connus de maladies génétiques et souhaitent créer un pool plus large d'embryons parmi lesquels choisir.
- Pour éviter les risques et les contraintes liés aux techniques de PMA existantes, qui peuvent inclure des injections hormonales, une surveillance étroite et le prélèvement d'ovules.
- Pour les couples de même sexe qui ne produisent naturellement que des ovules ou du sperme.
- Pour les personnes célibataires infertiles qui souhaitent créer un ovule ou du sperme à partir de leurs propres cellules souches afin de les féconder avec un donneur.
Que sont les cellules souches pluripotentes ?
Les cellules souches pluripotentes sont des cellules qui peuvent se transformer en n'importe quel autre type de cellule du corps. Au cours du développement de l'embryon, les populations de cellules souches mûrissent pour devenir différents types de cellules, perdant ainsi leur pluripotence. Cependant, il existe des méthodes permettant de « reprogrammer » une cellule mature pour lui redonner son état pluripotent. Ces cellules pluripotentes (iPS) peuvent alors produire n'importe quel type de cellule du corps.
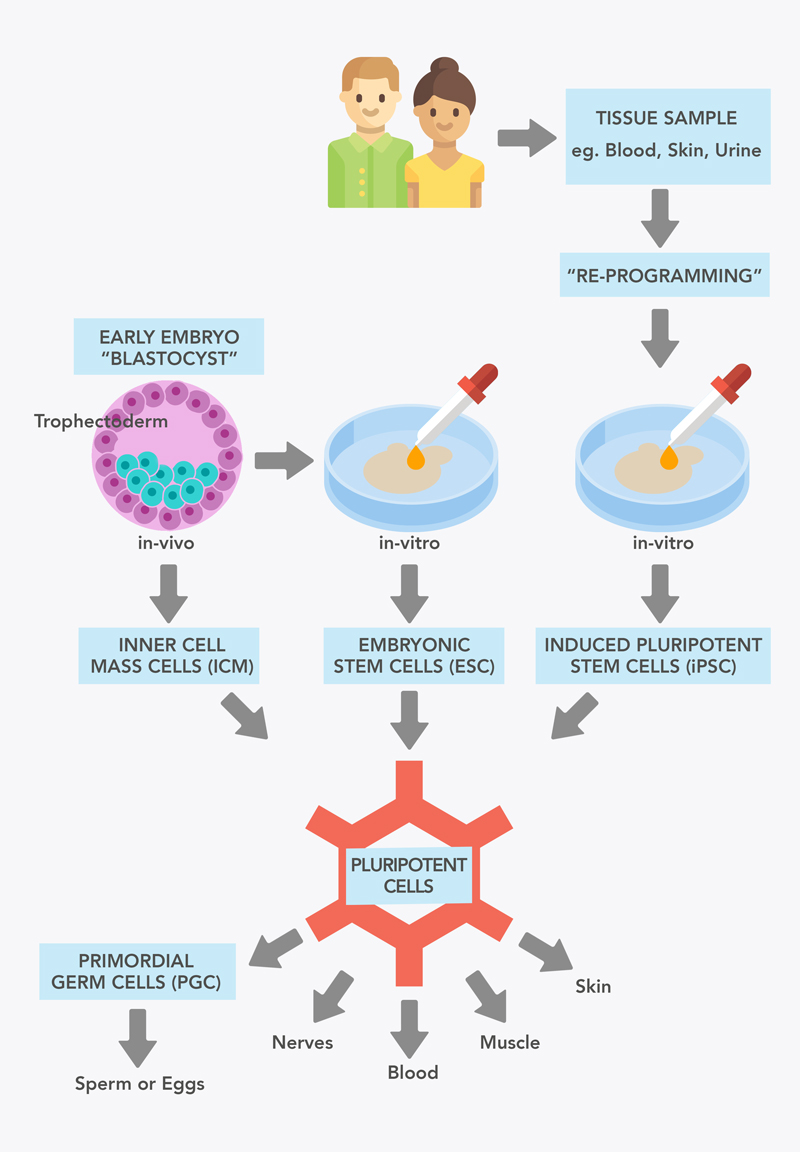
Figure 1 : Sources de cellules souches pluripotentes.
Un type de cellule souche pluripotente peut être obtenu à un stade très précoce du développement embryonnaire. À cinq jours, l'embryon est appelé blastocyste. Il se compose d'une couche externe de cellules appelée trophoblaste et d'une couche interne appelée masse cellulaire interne (MCI). Les cellules de la MCI sont pluripotentes, mais après leur implantation dans l'utérus, elles se développent en cellules et tissus embryonnaires.
Lorsque les cellules pluripotentes de l'ICM sont cultivées en dehors de l'embryon en laboratoire, elles sont appelées « cellules souches embryonnaires » (CSE). Les CSE ont été le premier type de cellules souches pluripotentes (CSP) mis à la disposition des chercheurs. Elles ont été obtenues pour la première fois à partir d'embryons humains en 1998.
Il n'existe pas de sources bien établies de cellules souches pluripotentes chez les enfants ou les adultes, car la plupart d'entre elles ont déjà un destin cellulaire déterminé. En 2006, le chercheur Shinya Yamanaka a démontré que les cellules de la peau de souris pouvaient également être transformées en cellules souches pluripotentes. Ce processus est connu sous le nom de « reprogrammation ». Ces cellules ressemblaient à des cellules souches embryonnaires et ont été baptisées « cellules souches pluripotentes induites » (CSPi). Tout comme les cellules souches embryonnaires, ces cellules ont le potentiel de former tous les types de cellules du corps, y compris potentiellement des ovules et des spermatozoïdes. Cette technologie s'est rapidement avérée efficace pour les cellules humaines. La génération d'iPS a révolutionné le domaine des cellules souches et la médecine dans son ensemble, et a été récompensée par le prix Nobel en 2012, seulement cinq ans après son application aux cellules humaines. Les cellules souches pluripotentes induites ont désormais été produites à partir de nombreux types de cellules, notamment des cellules cutanées, des cellules sanguines et même des cellules prélevées dans l'urine.
Utilisation de cellules souches pluripotentes pour produire des spermatozoïdes et des ovules sains
Chez la souris, des cellules souches pluripotentes ont été utilisées pour produire des spermatozoïdes et des ovules à partir de cellules murines. Il n'a pas encore été possible de produire des ovules et des spermatozoïdes à partir de cellules souches pluripotentes humaines, mais la production de cellules précurseurs (cellules germinales primordiales, ou PGC) a donné des résultats encourageants.
Les chercheurs japonais Katsuhiko Hayashi et Mitinori Saitou ont été les premiers à mettre au point la technologie de gamétogenèse in vitro (IVG) à partir de modèles animaux. En 2011, ils ont démontré que les PSC de souris pouvaient être reprogrammées pour devenir des spermatozoïdes, qui pouvaient à leur tour se développer en petits sains et fertiles. L'année suivante, ils ont démontré que les PSC de souris femelles pouvaient être transformées en ovules pouvant également donner naissance à des petits sains et fertiles.
Plusieurs facteurs ont été déterminants dans cette réussite :
- Le type de cellule de départ : après l'implantation de l'embryon, la masse cellulaire interne se transforme en cellules « épiblastiques ». Certaines de ces cellules épiblastiques quittent l'embryon en développement et se transforment en cellules germinales primordiales (PGC). Ces PGC migrent ensuite vers le fœtus et s'installent dans les ovaires ou les testicules en formation, où elles se transforment respectivement en ovules ou en spermatozoïdes. Certains chercheurs ont étudié comment produire des cellules similaires à ces cellules épiblastiques. Cependant, Hayashi et ses collègues ont montré que ces cellules n'étaient pas très efficaces pour produire des PGC. Ils ont donc développé un nouveau type de cellule épiblastique à partir de CSE de souris : la cellule épiblastique. Ce type de cellule est plus efficace pour se transformer en PGC, puis en ovules et en spermatozoïdes.
- Pureté du type cellulaire : Lorsqu'on transforme des cellules souches pluripotentes en types de cellules spécifiques, il est difficile d'obtenir que toutes les cellules réagissent exactement de la même manière. Cela peut conduire à une population mixte de cellules, comprenant des types de cellules indésirables ou des cellules qui conservent leur pluripotence et ne parviennent pas à former des ovules et des spermatozoïdes. Ces cellules peuvent également former des tumeurs. La purification des PGC est essentielle pour éliminer ces types de cellules indésirables, et ces études ont permis de mettre au point des méthodes pour y parvenir.
- Une condition nécessaire préalable à la maturation in vivo: le processus de production d'ovules et de spermatozoïdes fonctionnels et matures dans ces études a nécessité la transplantation des cellules de type PGC dans les ovaires ou les testicules de souris. Là, elles ont pu se développer davantage en ovules et en spermatozoïdes, ce qui n'avait pas été réalisé en laboratoire à l'époque. Il est important de comprendre comment l'ovaire/le testicule favorise cette maturation : cela permettra aux chercheurs d'essayer de recréer ces conditions en laboratoire, éliminant ainsi le recours à des procédures invasives et risquées ou à des testicules et ovaires fonctionnels.
D'autres recherches ont été menées pour améliorer cette technologie. En 2016, Saitou et Hayashi ont montré que les CSE et les iPSC de souris pouvaient être développées en ovules matures dans une boîte de culture, sans qu'il soit nécessaire de replacer les cellules dans les ovaires de souris pour leur maturation. Cependant, ils avaient encore besoin de tissus disséqués provenant d'ovaires de souris pour soutenir le développement des ovules.
La nécessité d'utiliser des tissus ovariens de souris a récemment été surmontée grâce aux travaux du laboratoire de Hayashi, qui a créé des cellules de soutien ovariennes à partir de cellules souches. Ces cellules ont permis de soutenir le développement de cellules de type PGC dérivées de cellules souches en ovules viables, qui ont pu être fécondés et produire des embryons viables.
De même, les travaux du laboratoire Zhou en Chine ont montré la création de cellules précurseurs de spermatozoïdes à partir de CSE de souris sans avoir besoin de tissu testiculaire, ce qui a permis pour la première fois une IVG complète sans avoir recours à des tissus provenant d'un modèle animal.
Qu'en est-il des humains ?
Certains chercheurs ont tenté de reproduire ces résultats à partir de cellules humaines, mais jusqu'à présent, ils n'ont pas réussi à produire des spermatozoïdes ou des ovules fonctionnels à partir de cellules souches humaines. Il existe encore des lacunes dans notre compréhension du développement embryonnaire humain naturel. Depuis le premier succès obtenu dans la production de cellules de type PGC à partir de cellules souches humaines in vitro, plusieurs groupes de recherche ont mis au point des méthodes plus efficaces ou plus perfectionnées pour produire des précurseurs de gamètes. Cependant, leur maturation en ovules et spermatozoïdes fonctionnels reste un défi.
En 2018, Yamashiro et ses collègues ont créé des cellules qui ressemblent à des ovules humains précoces à partir d'iPSCs. Cependant, ils ont eu recours à du tissu ovarien de souris pour favoriser la différenciation des cellules. De même, en 2021, Hwang et ses collègues ont dérivé des cellules précurseurs de spermatozoïdes humains à partir d'iPSC, mais ont à nouveau eu recours à des cellules testiculaires de souris pour favoriser leur développement.
Tests génétiques préimplantatoires
Les personnes ou les couples qui savent qu'ils sont porteurs d'une maladie génétique peuvent souhaiter éviter de la transmettre à leur enfant. Il n'existe actuellement qu'un seul moyen d'éviter activement l'implantation d'un embryon porteur d'une maladie génétique : le test génétique préimplantatoire (PGT), qui ne peut être utilisé qu'en association avec la FIV.
Après avoir été fécondés en clinique pour la FIV, les embryons sont cultivés pendant plusieurs jours jusqu'à ce qu'ils atteignent le stade de blastocyste, composé de la masse cellulaire interne et du trophectoderme qui l'entoure. Le trophectoderme est constitué des cellules qui formeront les structures de soutien telles que le placenta et les membranes amniotiques pendant la grossesse. À ce stade, les parents peuvent opter pour le PGT.
4 à 5 cellules sont prélevées sur le trophoectoderme. Ces cellules sont séquencées génétiquement afin de détecter la variante de la maladie. Les embryons qui ne sont pas porteurs de la variante génétique de la maladie sont identifiés et peuvent être transférés dans l'utérus de la mère d'intention ou de la mère porteuse, ou congelés pour une utilisation future. Cela réduit le nombre d'embryons qu'un couple peut utiliser et peut donc nécessiter un plus grand nombre d'embryons de départ. Dans certains cas, plusieurs cycles de FIV sont nécessaires avant d'obtenir une grossesse avec un embryon ne portant pas les variantes génétiques. Il n'est pas possible de tester génétiquement les ovules et le sperme avant la fécondation, car l'analyse de l'ADN des cellules avec les techniques actuelles détruirait les cellules.
Il a été suggéré que l'édition génétique pourrait potentiellement être utilisée pour corriger les mutations dans les embryons sélectionnés, au lieu de choisir ceux qui ne présentent pas de mutations. Cependant, d'importantes considérations techniques et éthiques s'y opposent. La technologie actuelle d'édition génétique peut affecter des parties non ciblées de l'ADN, provoquant des effets secondaires indésirables. Il serait également difficile de corriger la mutation dans toutes les cellules de l'embryon, ce qui ferait que certaines cellules seraient porteuses de la mutation et pourraient affecter la santé de l'enfant.
La production d'ovules et de spermatozoïdes à partir de cellules souches pluripotentes pourrait constituer une alternative à la modification génétique d'un embryon. En effet, la variante génétique pourrait être corrigée dans les cellules souches avant qu'elles ne soient utilisées pour produire les gamètes. La correction des variantes dans les cellules souches est déjà une technologie bien établie. Les cellules peuvent ensuite être criblées pour détecter les mutations hors cible avant la production d'ovules ou de spermatozoïdes. De plus, comme les cellules souches peuvent être facilement cultivées en grand nombre, il serait possible de produire un nombre de gamètes supérieur à celui qui serait généralement collecté lors d'un cycle de FIV. Voici quelques exemples illustrant comment l'hérédité des maladies génétiques pourrait être évitée.
- Édition génomique CRISPR/Cas9 : le code ADN des cellules souches pourrait être modifié. Cela pourrait consister à ajouter une section « manquante », à supprimer une section codant pour un gène pathogène ou à corriger une variante génétique dans un gène afin qu'il code pour un gène sain. Les cellules corrigées seraient ensuite sélectionnées et cultivées. Cela signifierait que tous les ovules et spermatozoïdes issus de ces cellules souches corrigées ne porteraient pas la variante pathogène. Les mutations involontaires (hors cible) pourraient également être testées avant la production d'ovules et de spermatozoïdes.
- Sélection : pour les maladies causées par le mosaïcisme (maladies dans lesquelles une modification génétique n'est présente que dans certaines cellules), il serait possible d'identifier et d'isoler des cellules souches pluripotentes uniques ne portant pas la variation responsable de la maladie. Ces cellules pourraient ensuite être cultivées pour la production d'ovules et de spermatozoïdes.
- Suppression des chromosomes supplémentaires : certaines affections qui altèrent la fertilité sont causées par une aneuploïdie chromosomique, c'est-à-dire lorsque l'individu possède un nombre anormal de chromosomes. Dans ce cas, les cellules souches pourraient également être utilisées pour produire des gamètes sans aneuploïdie. Chez la souris, des scientifiques ont réussi à supprimer des chromosomes supplémentaires de cellules pluripotentes et à les utiliser pour produire des petits en bonne santé. D'autres ont également modifié le nombre de chromosomes de cellules iPSC humaines pour créer des modèles du syndrome de Down (trisomie 21, où un chromosome 21 supplémentaire provoque un certain nombre de problèmes, notamment l'infertilité) et du syndrome de Klinefelter (où les individus ont des chromosomes XXY). Cette technique pourrait être appliquée à d'autres troubles humains causés par la présence de chromosomes supplémentaires. Une technologie similaire pourrait potentiellement être utilisée pour les individus qui produisent des ovules ou du sperme avec ajout ou suppression sporadique de chromosomes, un phénomène qui augmente avec l'âge.
Prochaines étapes
Actuellement, quatre obstacles majeurs doivent être surmontés avant de pouvoir appliquer le processus utilisé dans les études sur les souris à l'être humain :
En 2015, une étude britannique a réussi à produire des PGC avec une efficacité assez élevée, sans tissus de soutien ; environ 40 % des cellules se sont développées en cellules de type PGC. Les chercheurs pensent également avoir trouvé un moyen de purifier cette population de cellules de type PGC humaines afin d'éviter les tumeurs. Cette étude constitue un grand pas en avant vers la résolution des obstacles 1 et 2. Cependant, aucun effort visant à faire mûrir ou à transplanter ces cellules n'a été signalé.
D'autres laboratoires s'efforcent de créer les cellules somatiques de soutien des testicules ou des ovaires, et même de créer des répliques in vitro en 3D de tissus ovariens ou testiculaires (appelés organoïdes) dérivés entièrement de cellules souches. Cela pourrait être nécessaire pour produire des gamètes pleinement fonctionnels in vitro, et pourrait également être utilisé pour de nombreuses autres applications en médecine reproductive, telles que le criblage de médicaments, la modélisation de maladies et l'évaluation de l'impact des polluants environnementaux.
Relever les défis juridiques, éthiques et sociaux
Outre la levée des obstacles scientifiques, les prochaines étapes doivent également tenir compte des obstacles sociaux, éthiques et juridiques importants. La législation régissant l'utilisation et la création d'embryons varie à travers le monde et reflète souvent la culture et les normes sociales propres à chaque pays, ainsi que la législation existante dans des domaines similaires de la recherche et de la médecine. Si les technologies d'IVG deviennent scientifiquement réalisables, la législation devra être modifiée pour permettre leur application clinique. Toute réforme réglementaire sera probablement influencée par l'opinion publique sur l'IVG et les technologies de reproduction, et plus particulièrement sur la manière dont seront abordées les questions éthiques fondamentales telles que l'éligibilité à ces technologies, l'égalité d'accès à celles-ci et, surtout, les mesures qui seront mises en place pour assurer un suivi approprié de la santé des enfants issus de ces technologies.
Pourrions-nous créer des ovules à partir de cellules souches mâles ou du sperme à partir de cellules souches femelles en laboratoire ?
Il n'existe actuellement aucune preuve chez l'être humain que la GII puisse être utilisée pour créer du sperme à partir de cellules souches féminines ou des ovules à partir de cellules souches masculines. Cependant, certaines recherches menées sur des souris fournissent des preuves que cela pourrait être possible.
reuves de la production d'ovules à partir de cellules souches pluripotentes XY (masculines) ou de sperme à partir de cellules souches pluripotentes XX (féminines) :
En 2018, Li et ses collègues ont créé des souris vivantes avec deux mères (bimaternelles) et des souris vivantes avec deux pères (bipaternelles). Cependant, les souris bipaternelles n'étaient pas viables à long terme, car elles mouraient peu après leur naissance.
En 2023, Murakami et ses collègues ont réussi à convertir des cellules souches XY (masculines) en cellules souches XX (féminines). Ces cellules souches XY --> XX ont ensuite produit des ovules matures et fonctionnels avec la même efficacité que les cellules souches XX naturelles. Une fois fécondés, ces ovules ont donné naissance à une progéniture vivante, fournissant ainsi la preuve de la reproduction bipaternelle chez la souris.
Preuves contre la production d'ovules à partir de cellules XY (mâles) ou de spermatozoïdes à partir de cellules XX (femelles) :
Bien que l'article de Murakami et ses collègues publié en 2023 indique que cela pourrait être possible, des décennies de recherches antérieures sur la formation des gamètes chez les mammifères et la sélection du sexe ont remis en question la possibilité de former des ovules à partir de cellules portant des chromosomes XY, ou du sperme à partir de cellules qui n'en possèdent pas (revue dans Taketo 2015). Ces études antérieures soutiennent que la production de sperme à partir de cellules XX (féminines) ou d'ovules à partir de cellules XY (masculines) n'était pas possible. En outre, l'obstacle au développement d'individus sains est observé dans les aneuploïdies des chromosomes sexuels humains associées à la stérilité, notamment :
- Femmes XY - Syndrome de Swyer
- Hommes XX - Syndrome de De la Chapelle
- Hommes XXY - Syndrome de Klinefelter
- Femmes XO - Syndrome de Turner
Il est important de noter que la plupart de ces études portent sur des conditions dans lesquelles les ovules ou les spermatozoïdes et l'environnement de soutien des ovaires ou des testicules présentent des dysfonctionnements génétiques. Aucune expérience consistant à introduire des PGC XY sains dans un ovaire XX sain ou des PGC XX sains dans un testicule XY sain n'a encore été réalisée. Cependant, ces expériences seraient théoriquement possibles en utilisant les méthodes de Hayashi décrites ci-dessus.
Des recherches supplémentaires sont nécessaires pour déterminer si les travaux de Murakami et de ses collègues peuvent être reproduits de manière fiable.
