Fortpflanzung und Fruchtbarkeit: Wie können Gen- und Zelltherapie helfen?
Für viele Menschen, die aufgrund fehlender oder minderwertiger Eizellen oder Spermien keine leiblichen Kinder bekommen können, sind Zeitungsberichte über Wissenschaftler, die im Labor aus Stammzellen Spermien oder Eizellen herstellen, möglicherweise bahnbrechend. Aber was steckt hinter diesen Schlagzeilen und wo liegen die Grenzen für weitere Fortschritte? Dieses Informationsblatt fasst die jüngsten Entwicklungen bei der Behandlung von Unfruchtbarkeit und genetischen Erkrankungen mit Eizellen und Spermien aus Stammzellen zusammen.
Was wissen wir?
Stammzellen haben die Fähigkeit, sich unter den richtigen Bedingungen zu verschiedenen Zelltypen zu entwickeln. Einige Stammzellen können jeden Zelltyp des Körpers produzieren. Diese werden als pluripotent bezeichnet.
Pluripotente Stammzellen können aus fünf Tage alten Embryonen gewonnen werden, bevor sich der Embryo in die Gebärmutter eingenistet hat. Diese Zellen (embryonale Stammzellen oder ESCs) können im Labor in großer Zahl gezüchtet werden, wobei sie ihre Fähigkeit, sich zu anderen Zelltypen zu entwickeln, behalten.
luripotente Stammzellen können auch durch „Umprogrammierung” anderer Körperzellen im Labor hergestellt werden, beispielsweise aus Hautzellen (diese werden als induzierte pluripotente Stammzellen oder iPS-Zellen bezeichnet).
Diese Stammzellen sind für mögliche Fertilitätsbehandlungen von besonderem Interesse, da Wissenschaftler möglicherweise pluripotente Stammzellen zur Herstellung von Spermien und Eizellen (zusammen als Gameten bezeichnet) für die In-vitro-Fertilisation verwenden können. Der Prozess der Herstellung von Spermien und Eizellen im Labor wird als In-vitro-Gametogenese oder IVG bezeichnet.
Während Mäuse mithilfe von aus Stammzellen und IVG erzeugten Eizellen und Spermien hergestellt wurden, ist dies beim Menschen noch nicht gelungen.
Woran arbeiten die Forscher?
Die aktuelle Forschung konzentriert sich auf verschiedene Aspekte der IVG.
- Einige Gruppen entwickeln neue Methoden zur Herstellung von Vorläuferzellen für Eizellen und Spermien (primordiale Keimzellen oder PGCs) aus menschlichen pluripotenten Stammzellen und versuchen dann herauszufinden, wie diese zu Spermien oder Eizellen weiterentwickelt werden können.
- Andere Gruppen versuchen, eine unterstützende Umgebung zu schaffen, in der sich diese Vorläuferzellen im Labor zu Spermien oder Eizellen entwickeln können, was bedeutet, dass sie die sich entwickelnden Hoden oder Eierstöcke nachbilden müssen. Dazu müssen Stammzellen dazu gebracht werden, sich zu anderen Zelltypen der Hoden (wie Sertoli-Zellen, die die PGC-Entwicklung unterstützen, oder Leydig-Zellen, die Testosteron produzieren) oder der Eierstöcke (wie Granulosazellen, die die Eizellenentwicklung unterstützen) zu entwickeln.
- Diese Methoden werden auch eingesetzt, um die Ursachen für Störungen der Hoden- oder Eierstockentwicklung zu verstehen, die sich wiederum auf die Fruchtbarkeit oder die Geschlechtsmerkmale auswirken. Diese Art der Forschung wird als Krankheitsmodellierung bezeichnet. Sie kann die Untersuchung der Gene umfassen, die für die verschiedenen Schritte der Bildung funktionsfähiger Eierstöcke und Hoden sowie von Eizellen und Spermien erforderlich sind.
Was sind die Herausforderungen?
Wenn Eizellen und Spermien durch IVG aus anderen adulten Körperzelltypen hergestellt werden könnten, hätte dies weitreichende Anwendungsmöglichkeiten für Menschen, die von Unfruchtbarkeit betroffen sind oder genetische Krankheiten weitervererben könnten. Derzeit gibt es jedoch vier wesentliche Hindernisse für die Anwendung von IVG-Technologien beim Menschen:
- Herstellung einer ausreichenden Anzahl lebensfähiger Eizellen- und Spermienvorläuferzellen (PGCs) aus Stammzellen.
- Sicherstellung, dass diese menschlichen PGCs Eizellen und Spermien bilden, aber keine Tumore entwickeln, was bei pluripotenten Zellen ein Risiko darstellen kann.
- Erarbeitung eines Verfahrens zur Reifung menschlicher PGCs zu voll funktionsfähigen Eizellen und Spermien im Labor, um die Transplantation unreifer PGCs in den menschlichen Körper zu vermeiden. Dadurch würden invasive Eingriffe entfallen und das Risiko der Tumorbildung vermieden.
- Festlegen, wie die Fähigkeit von im Labor erzeugten Spermien und Eizellen zur Erzeugung gesunder Embryonen und Kinder getestet werden kann, angesichts der derzeitigen Beschränkungen in vielen Ländern hinsichtlich der Erzeugung von Embryonen für Forschungszwecke oder deren Wachstum im Labor über bestimmte Entwicklungszeitpunkte hinaus.
Neben der Überwindung der wissenschaftlichen Hindernisse müssen in den nächsten Schritten auch die erheblichen sozialen, ethischen und rechtlichen Hindernisse für den Einsatz von IVG berücksichtigt werden. Die Rechtsvorschriften für die Verwendung und Erzeugung von Embryonen sind weltweit unterschiedlich. Wenn IVG-Technologien wissenschaftlich realisierbar werden, müssen die Rechtsvorschriften geändert werden, um eine klinische Anwendung zu ermöglichen.
Einführung in assistierte Reproduktionstechnologien
Assistierte Reproduktionstechnologien (ART) sind Technologien, die Paare oder Einzelpersonen dabei unterstützen, ohne Geschlechtsverkehr eine Schwangerschaft zu erzielen. Dabei werden Spermien, Eizellen oder Embryonen außerhalb des Körpers manipuliert. Zu den ART-Verfahren gehört die In-vitro-Fertilisation (IVF), bei der Embryonen im Labor erzeugt und anschließend in die Gebärmutter einer Wunschmutter oder Leihmutter übertragen werden. ART kann auch die Verwendung von gespendeten Keimzellen (Spermien oder Eizellen) oder befruchteten Embryonen umfassen.
ART kann aus verschiedenen Gründen eingesetzt werden:
- Unfruchtbarkeit: Die Weltgesundheitsorganisation berichtet, dass jeder sechste Erwachsene von Unfruchtbarkeit betroffen ist und daher möglicherweise keine Kinder zeugen kann. Unfruchtbarkeit kann durch eine Reihe von Erkrankungen und Faktoren verursacht werden und jeden Menschen treffen.
- Verwendung von gespendeten Keimzellen: Menschen mit Unfruchtbarkeit, gleichgeschlechtliche Paare oder Menschen, die sich als Alleinerziehende ein Kind wünschen, können sich dafür entscheiden, mit gespendeten Keimzellen schwanger zu werden
- Bekannte genetische Risiken: Wenn ein oder beide Elternteile wissen, dass sie Träger einer lebensverkürzenden genetischen Erkrankung sind, können sie sich für eine IVF und eine Präimplantationsdiagnostik entscheiden. Bei diesem Verfahren werden die Embryonen untersucht und diejenigen ausgewählt, die die genetische Mutation nicht tragen, um zu verhindern, dass die spezifische genetische Erkrankung der Eltern an das Kind weitergegeben wird.
Aktuelle Behandlungen und Unterstützung
Für Personen oder Paare mit geringer Fruchtbarkeit oder Unfruchtbarkeit ermöglichen assistierte Reproduktionstechniken (ART) wie die In-vitro-Fertilisation (IVF) die Befruchtung von Eizellen mit Spermien im Labor. Reife Eizellen werden aus den Eierstöcken entnommen. Dazu werden Medikamente eingesetzt, die den natürlichen Menstruationszyklus unterdrücken, sowie Hormonpräparate, die die Reifung der Eizellen stimulieren. Die Eizellen werden dann entnommen und im Labor mit Spermien befruchtet.
Die entstandenen Embryonen werden bis zu 6 Tage lang kultiviert und ihre Entwicklung wird beurteilt. Wenn einer der Elternteile Träger einer lebensverkürzenden genetischen Erkrankung ist, kann zu diesem Zeitpunkt eine Präimplantationsdiagnostik durchgeführt werden, bei der die Gene des Embryos im Labor untersucht werden. Embryonen ohne die Mutation, die die Erkrankung verursacht, werden identifiziert, sodass die Erkrankung nicht an das Kind weitergegeben wird. Die Embryonen können dann in die Gebärmutter der Wunschmutter oder Leihmutter übertragen oder für eine spätere Verwendung eingefroren und gelagert werden.
Damit die derzeitigen ART-Technologien jedoch zu einem biologisch verwandten Embryo führen, muss mindestens ein Elternteil über lebensfähige Keimzellen verfügen.
Für Einzelpersonen und Paare, denen geeignete Spermien oder Eizellen fehlen, können Spenderkeimzellen oder Spenderembryonen angeboten werden. Dies würde bedeuten, dass das Kind genetisch nicht mit einem oder beiden Wunschelternteilen verwandt ist. Der Zugang zu Spenderkeimzellen oder gespendeten Embryonen kann aufgrund der Einschränkungen und Beschränkungen im Zusammenhang mit der Spende sowie der begrenzten Anzahl von Spendern schwierig sein.
Als zusätzliche Optionen ohne künstliche Reproduktionstechniken gibt es derzeit die Adoption und die Entscheidung, kinderlos zu bleiben.
How might gene and cell therapies help?
Um einen biologisch verwandten Embryo zu erzeugen, muss bei den bestehenden künstlichen Reproduktionstechniken mindestens ein Elternteil gesunde, funktionsfähige Eizellen oder Spermien haben. Forscher untersuchen jedoch, wie gesunde Eizellen und Spermien aus Stammzellen im Labor hergestellt werden können (sogenannte In-vitro-Gametogenese oder IVG), aber dies ist beim Menschen noch nicht gelungen.
Es gibt mehrere Gründe, warum eine Person oder ein Paar potenziell von IVG profitieren könnte:
- Wenn bestehende ARTs erfolglos waren.
- Wenn bestehende ARTs aufgrund fehlender Eierstöcke/Hoden, Eizellen/Spermien oder aufgrund von Unfruchtbarkeit aufgrund von Alter oder Krebsbehandlung nicht geeignet sind.
- Wenn Paare bekannte Träger genetischer Erkrankungen sind und einen größeren Pool an Embryonen zur Auswahl schaffen möchten.
- Um die Risiken und Belastungen bestehender ARTs zu vermeiden, zu denen Hormonspritzen, engmaschige Überwachung und Eizellentnahme gehören können.
- Für gleichgeschlechtliche Paare, die nur auf natürliche Weise nur entweder Eizellen oder Spermien produzieren.
- Für alleinstehende Personen, die unfruchtbar sind und aus ihren eigenen Stammzellen eine Eizelle oder Spermien erzeugen möchten, die mit einem Spender befruchtet werden sollen.
- Für alleinstehende Personen, die ihre eigenen natürlichen Eizellen oder Spermien mit entsprechenden aus Stammzellen gewonnenen Eizellen oder Spermien von sich selbst verwenden möchten, um alleiniger genetischer Elternteil zu sein.
How could stem cells be used to help reproductive issues?
Was sind pluripotente Stammzellen?
Pluripotente Stammzellen sind Zellen, die sich in jeden anderen Zelltyp des Körpers verwandeln können. Während sich ein Embryo entwickelt, reifen Populationen von Stammzellen zu verschiedenen Zelltypen heran und verlieren dabei ihre Pluripotenz. Es gibt jedoch Methoden, um eine reife Zelle wieder in diesen pluripotenten Zustand „umzuprogrammieren”, und diese pluripotenten Zellen (iPSCs) können dann jeden beliebigen Zelltyp des Körpers produzieren.
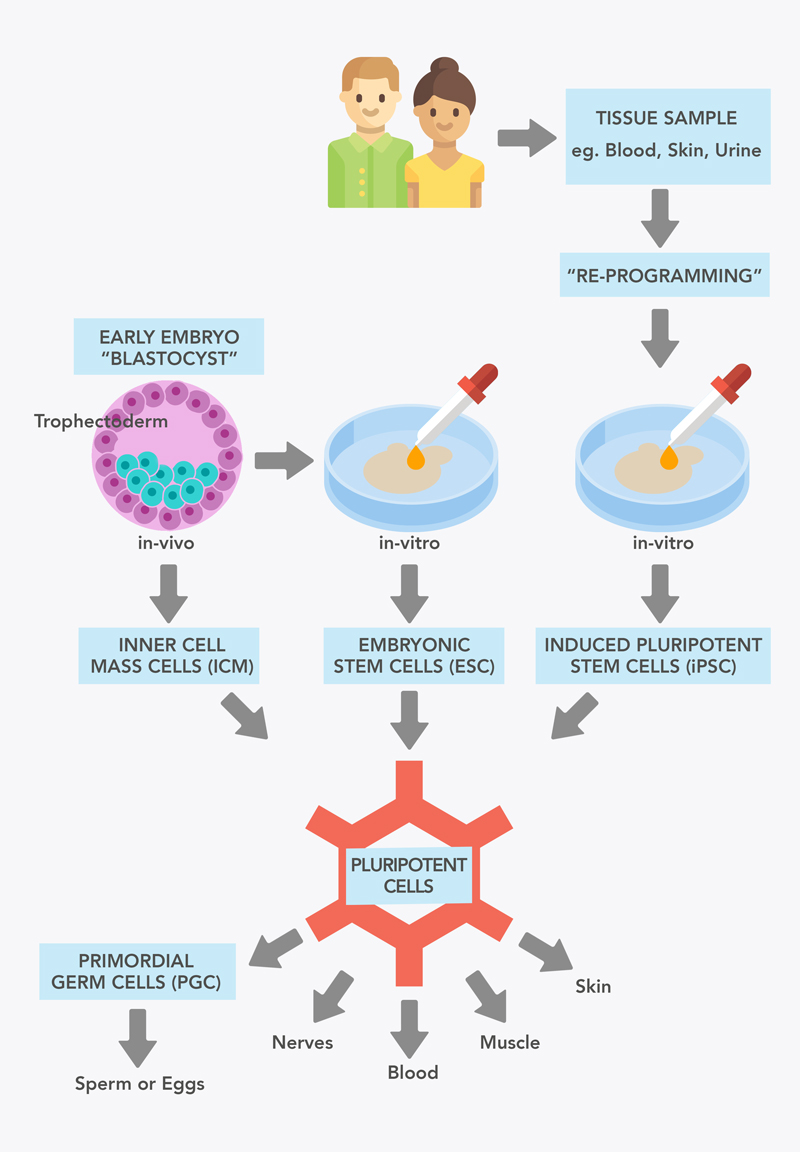
Abbildung 1: Quellen pluripotenter Stammzellen.
Eine Art pluripotenter Stammzellen kann in einem sehr frühen Stadium der Embryonalentwicklung gewonnen werden. Im Alter von fünf Tagen wird der Embryo als Blastozyste bezeichnet. Diese besteht aus einer äußeren Zellschicht, dem Trophoblasten, und einer inneren Schicht, der inneren Zellmasse (ICM). Die Zellen der ICM sind pluripotent, entwickeln sich jedoch nach der Einnistung in die Gebärmutter zu embryonalen Zellen und Geweben.
Wenn pluripotente Zellen der ICM außerhalb des Embryos im Labor gezüchtet werden, werden sie als embryonale Stammzellen (ESCs) bezeichnet. ESCs waren die ersten pluripotenten Stammzellen (PSCs), die Forschern zur Verfügung standen. Sie wurden erstmals 1998 aus menschlichen Embryonen gewonnen.
Es gibt keine etablierten Quellen für pluripotente Stammzellen bei Kindern oder Erwachsenen, da die meisten dieser Zellen bereits eine bestimmte Zellfunktion übernommen haben. Im Jahr 2006 zeigte der Forscher Shinya Yamanaka, dass auch Hautzellen von Mäusen zu pluripotenten Stammzellen umgewandelt werden können. Dieser Prozess wird als „Re-programmierung” bezeichnet. Diese Zellen ähnelten embryonalen Stammzellen und wurden als induzierte pluripotente Stammzellen (iPSCs) bezeichnet. Diese Zellen haben wie embryonale Stammzellen das Potenzial, alle Zelltypen des Körpers zu bilden, einschließlich potenziell Eizellen und Spermien. Es zeigte sich schnell, dass diese Technologie auch bei menschlichen Zellen funktioniert. Die Erzeugung von iPSCs war revolutionär für die Stammzellforschung und die Medizin insgesamt und wurde nur fünf Jahre nach der Anwendung dieser Technologie bei menschlichen Zellen mit dem Nobelpreis ausgezeichnet. Induzierte pluripotente Stammzellen wurden inzwischen aus vielen Zelltypen hergestellt, darunter Hautzellen, Blutzellen und sogar aus Urin gewonnene Zellen.
Verwendung pluripotenter Stammzellen zur Herstellung gesunder Spermien und Eizellen
Bei Mäusen wurden pluripotente Stammzellen verwendet, um aus Mauszellen Spermien und Eizellen herzustellen. Aus menschlichen pluripotenten Stammzellen wurden bisher noch keine Eizellen und Spermien hergestellt, obwohl bei der Herstellung der Vorläuferzellen (primordiale Keimzellen, PGCs) einige Erfolge erzielt wurden.
Die japanischen Forscher Katsuhiko Hayashi und Mitinori Saitou leisteten Pionierarbeit bei der In-vitro-Gametogenese (IVG) an Tiermodellen. Im Jahr 2011 zeigten sie, dass PSCs aus Mäusen zu Spermien umprogrammiert werden können, aus denen sich wiederum gesunde und fruchtbare Jungtiere entwickeln können. Im folgenden Jahr zeigten sie, dass weibliche Maus-PSCs in Eizellen umgewandelt werden können, aus denen sich ebenfalls gesunde und fruchtbare Jungtiere entwickeln können.
Mehrere Faktoren waren für diesen Erfolg entscheidend:
- Der Ausgangszelltyp: Nach der Einnistung des Embryos verwandelt sich die innere Zellmasse in „Epiblast”-Zellen. Einige dieser Epiblast-Zellen verlassen den sich entwickelnden Embryo und verwandeln sich in primordiale Keimzellen (PGCs). Diese PGCs wandern später zurück in den Fötus und lassen sich in den sich bildenden Eierstöcken oder Hoden nieder, wo sie sich zu Eizellen bzw. Spermien entwickeln. Einige Forscher haben untersucht, wie man Zellen herstellen kann, die diesen Epiblastzellen ähneln. Hayashi und seine Kollegen zeigten jedoch, dass diese Zellen nicht sehr effektiv bei der Bildung von PGCs waren. Stattdessen entwickelten sie einen neuen Typ von Epiblastzellen aus Maus-ESCs: die Epiblast-ähnliche Zelle. Dieser Zelltyp ist erfolgreicher bei der Umwandlung in PGCs und anschließend in Eizellen und Spermien.
- Zelltyp-Reinheit: Bei der Umwandlung pluripotenter Stammzellen in bestimmte Zelltypen ist es schwierig, alle Zellen dazu zu bringen, genau gleich zu reagieren. Dies kann zu einer gemischten Zellpopulation führen, die auch Zelltypen enthält, die nicht erwünscht sind, oder Zellen, die ihre Pluripotenz behalten und keine Eizellen oder Spermien bilden. Diese Zellen können auch Tumore bilden. Die Reinigung der PGCs ist entscheidend, um diese unerwünschten Zelltypen zu entfernen, und diese Studien haben Wege entwickelt, dies zu erreichen.
- Eine Voraussetzung für die In-vivo-Reifung: Der Prozess der Herstellung funktionsfähiger, reifer Eizellen und Spermien in diesen Studien erforderte die Transplantation der PGC-ähnlichen Zellen zurück in die Eierstöcke bzw. Hoden von Mäusen. Dort wurden sie in ihrer weiteren Entwicklung zu Eizellen und Spermien unterstützt, was zu diesem Zeitpunkt im Labor noch nicht gelungen war. Es ist wichtig herauszufinden, wie der Eierstock bzw. Hoden diese Reifung unterstützt, damit Forscher versuchen können, diese Bedingungen im Labor nachzubilden, wodurch invasive und riskante Verfahren oder funktionsfähige Hoden und Eierstöcke überflüssig würden.
Weitere Forschungen haben diese Technologie weiter verbessert. Im Jahr 2016 zeigten Saitou und Hayashi, dass Maus-ES-Zellen und iPS-Zellen in einer Petrischale zu reifen Eizellen entwickelt werden können, ohne dass die Zellen zur Reifung wieder in die Eierstöcke von Mäusen zurückgesetzt werden müssen. Allerdings benötigten sie noch immer Gewebe aus Mäuseeierstöcken, um die Entwicklung der Eizellen zu unterstützen.
Der Bedarf an Maus-Eierstockgewebe wurde kürzlich durch Arbeiten aus Hayashis Labor überwunden, als Eierstock-Stützzellen aus Stammzellen erzeugt wurden. Diese Zellen waren in der Lage, die Entwicklung von aus Stammzellen gewonnenen PGC-ähnlichen Zellen zu lebensfähigen Eizellen zu unterstützen, die befruchtet werden und lebensfähige Embryonen hervorbringen konnten
In ähnlicher Weise zeigte die Arbeit des Zhou-Labors in China die Erzeugung von spermienähnlichen Vorläuferzellen aus Maus-ES-Zellen ohne die Notwendigkeit von Hodengewebe, wodurch erstmals eine vollständige IVG ohne Gewebe aus einem Tiermodell möglich wurde.
What about in humans?
Einige Forscher haben versucht, diese Ergebnisse mit menschlichen Zellen zu reproduzieren, aber bisher ist es ihnen nicht gelungen, aus menschlichen Stammzellen funktionsfähige Spermien oder Eizellen herzustellen. Es gibt noch immer Lücken in unserem Verständnis der natürlichen Entwicklung menschlicher Embryonen. Seit dem ersten Erfolg bei der Herstellung von PGC-ähnlichen Zellen aus menschlichen Stammzellen in vitro haben eine Reihe von Forschungsgruppen effizientere oder verfeinerte Methoden zur Herstellung der Gametenvorläufer entwickelt. Die Reifung dieser Vorläufer zu funktionsfähigen Eizellen und Spermien bleibt jedoch eine Herausforderung.
Im Jahr 2018 schufen Yamashiro und Kollegen Zellen, die frühen menschlichen Eizellen aus iPS-Zellen ähneln. Allerdings waren sie dabei auf die Verwendung von Maus-Eierstockgewebe angewiesen, um die Differenzierung der Zellen zu unterstützen. In ähnlicher Weise haben Hwang und Kollegen im Jahr 2021 menschliche Spermienvorläuferzellen aus iPS-Zellen gewonnen, waren jedoch erneut auf Maus-Hodenzellen angewiesen, um die Entwicklung zu unterstützen.
Wie könnten genetische Krankheiten mit aus pluripotenten Stammzellen gewonnenen Eizellen und Spermien vermieden werden?
Präimplantationsdiagnostik
Personen oder Paare, die wissen, dass sie Träger einer genetischen Erkrankung sind, möchten möglicherweise vermeiden, diese Erkrankung an ihr Kind weiterzugeben. Derzeit gibt es nur eine Möglichkeit, die Implantation eines Embryos mit einer genetischen Erkrankung aktiv zu vermeiden: die Präimplantationsdiagnostik (PID), die nur in Verbindung mit einer IVF angewendet werden kann.
Nachdem die Embryonen in der Klinik für die IVF befruchtet wurden, werden sie mehrere Tage lang kultiviert, bis sie das Blastozystenstadium erreichen, das aus der inneren Zellmasse und dem umgebenden Trophoblasten besteht. Der Trophoblast besteht aus Zellen, aus denen während der Schwangerschaft Stützstrukturen wie die Plazenta und die Fruchtblasen gebildet werden. In diesem Stadium können sich die Eltern für eine PGT entscheiden
Aus dem Trophektoderm werden 4–5 Zellen entnommen. Diese Zellen werden genetisch auf die Krankheitsvariante untersucht. Embryonen, die die genetische Variante für die Erkrankung nicht tragen, werden identifiziert und können in die Gebärmutter der Wunscheltern oder der Leihmutter übertragen oder für eine spätere Verwendung eingefroren werden. Dadurch verringert sich die Anzahl der Embryonen, die ein Paar verwenden kann, sodass möglicherweise eine größere Anzahl von Embryonen benötigt wird. In einigen Fällen sind mehrere IVF-Zyklen erforderlich, bevor eine Schwangerschaft mit einem Embryo erreicht werden kann, der die genetischen Varianten nicht trägt. Es ist nicht möglich, Eizellen und Spermien vor der Befruchtung genetisch zu testen, da die Analyse der Zell-DNA mit den derzeitigen Techniken die Zelle zerstören würde.
Es wurde vorgeschlagen, dass die Gen-Editierung möglicherweise verwendet werden könnte, um Mutationen in untersuchten Embryonen zu korrigieren, anstatt diejenigen ohne Mutationen auszuwählen. Allerdings gibt es erhebliche technische und ethische Bedenken, die dies verhindern. Die derzeitige Genbearbeitungstechnologie kann nicht-zielgerichtete Teile der DNA beeinflussen und unerwünschte Nebenwirkungen verursachen. Es wäre auch schwierig, die Mutation in jeder Zelle des Embryos zu korrigieren, was dazu führen würde, dass einige Zellen die Mutation tragen und möglicherweise die Gesundheit des Kindes beeinträchtigen.
Die Herstellung von Eizellen und Spermien aus pluripotenten Stammzellen könnte eine Alternative zum Versuch der Genbearbeitung in einem Embryo darstellen. Denn die genetische Variante könnte in den Stammzellen korrigiert werden, bevor diese zur Herstellung der Keimzellen verwendet werden. Die Korrektur von Varianten in Stammzellen ist bereits eine etablierte Technologie. Die Zellen können dann auf Off-Target-Mutationen untersucht werden, bevor Eizellen oder Spermien hergestellt werden. Da Stammzellen leicht in großer Zahl gezüchtet werden können, könnte außerdem eine größere Anzahl von Keimzellen produziert werden, als normalerweise in einem IVF-Zyklus gewonnen werden. Nachfolgend finden Sie einige Beispiele, wie die Vererbung genetischer Krankheiten vermieden werden könnte.
- CRISPR/Cas9-Genom-Editierung: Der DNA-Code von Stammzellen könnte verändert werden. Dies könnte bedeuten, dass ein „fehlender” Abschnitt hinzugefügt, ein Abschnitt, der für ein Krankheitsgen kodiert, entfernt oder eine genetische Variante in einem Gen korrigiert wird, sodass es für ein gesundes Gen kodiert. Die korrigierten Zellen würden dann ausgewählt und vermehrt werden. Dies würde bedeuten, dass alle aus diesen korrigierten Stammzellen hergestellten Eizellen und Spermien die krankheitsverursachende Variante nicht mehr tragen würden. Unbeabsichtigte Mutationen (Off-Targets) könnten ebenfalls vor der Produktion von Eizellen und Spermien getestet werden.
- Auswahl: Bei Erkrankungen, die durch Mosaizismus verursacht werden (Erkrankungen, bei denen eine genetische Veränderung nur in einigen Zellen auftritt), könnten einzelne pluripotente Stammzellen, die nicht die krankheitsverursachende Variation tragen, identifiziert und isoliert werden. Diese Zellen könnten dann für die Produktion von Eizellen und Spermien gezüchtet werden.
- Entfernung zusätzlicher Chromosomen: Einige Erkrankungen, die die Fruchtbarkeit beeinträchtigen, werden durch chromosomale Aneuploidie verursacht, bei der eine Person zu viele oder zu wenige Chromosomen hat. In diesem Fall könnten Stammzellen auch verwendet werden, um Keimzellen ohne Aneuploidie herzustellen. Bei Mäusen ist es Wissenschaftlern gelungen, zusätzliche Chromosomen aus pluripotenten Zellen zu entfernen und daraus gesunde Jungtiere zu erzeugen. Andere haben auch die Chromosomenzahl für menschliche iPSC-Zellmodelle für das Down-Syndrom (Trisomie 21, bei der ein zusätzliches Chromosom 21 eine Reihe von Problemen einschließlich Unfruchtbarkeit verursacht) und das Klinefelter-Syndrom (bei dem Personen XXY-Chromosomen haben) verändert. Dies könnte auf andere menschliche Erkrankungen angewendet werden, die durch das Vorhandensein zusätzlicher Chromosomen verursacht werden. Eine ähnliche Technologie könnte potenziell bei Personen eingesetzt werden, die Eizellen oder Spermien mit sporadischen Chromosomenadditionen oder -deletionen produzieren, ein Phänomen, das mit zunehmendem Alter zunimmt.
Nächste Schritte
Derzeit gibt es vier große Hindernisse, die überwunden werden müssen, bevor das in den Studien an Mäusen verwendete Verfahren beim Menschen angewendet werden kann:
- Herstellung einer großen Anzahl von PGCs ohne Verwendung von fötalem Gewebe zur Unterstützung des Prozesses.
- Sicherstellung, dass diese menschlichen PGCs Eizellen und Spermien produzieren, aber keine Tumore, und Entwicklung von Methoden zur Sortierung der entstehenden Gameten, um sicherzustellen, dass undifferenzierte Stammzellen entfernt werden.
- Es muss herausgefunden werden, wie menschliche PGCs im Labor zu Eizellen und Spermien heranreifen können, ohne dass sie in Menschen transplantiert werden müssen und ohne dass tierisches oder menschliches Gewebe zur Unterstützung dieses Prozesses erforderlich ist. Dadurch werden sowohl ein invasiver Eingriff als auch das Tumorrisiko vermieden.
- Die langfristige Sicherheit und Lebensfähigkeit der durch IVG erzeugten Spermien und Eizellen muss getestet werden. Angesichts der derzeitigen Beschränkungen für die Erzeugung menschlicher Embryonen oder deren Züchtung im Labor über bestimmte Entwicklungszeitpunkte hinaus ist dies eine Herausforderung.
Im Jahr 2015 gelang es in einer britischen Studie am Menschen, PGCs mit recht hoher Effizienz und ohne Stützgewebe herzustellen; etwa 40 % der Zellen entwickelten sich zu PGC-ähnlichen Zellen. Die Forscher glauben auch, einen Weg gefunden zu haben, diese PGC-ähnliche Population zu reinigen, um Tumore zu vermeiden. Diese Studie ist ein großer Schritt zur Überwindung der Hindernisse 1 und 2. Es wurden jedoch keine Bemühungen zur Reifung oder Transplantation dieser Zellen berichtet.
Andere Labore arbeiten daran, die unterstützenden somatischen Zellen der Hoden oder Eierstöcke zu erzeugen und sogar 3D-in vitro-Replikate von Eierstock- oder Hodengewebe (sogenannte Organoide) zu erzeugen, die vollständig aus Stammzellen gewonnen werden. Dies könnte erforderlich sein, um voll funktionsfähige Gameten in vitro zu produzieren, und könnte auch für viele andere Anwendungen in der Reproduktionsmedizin genutzt werden, beispielsweise für das Screening von Medikamenten, die Modellierung von Krankheiten und die Bewertung der Auswirkungen von Umweltschadstoffen.
Bewältigung rechtlicher, ethischer und sozialer Herausforderungen
Neben der Überwindung der wissenschaftlichen Hindernisse müssen in den nächsten Schritten auch die erheblichen sozialen, ethischen und rechtlichen Hindernisse berücksichtigt werden. Die Rechtsvorschriften für die Verwendung und Erzeugung von Embryonen sind weltweit unterschiedlich und spiegeln oft die einzigartige Kultur und die sozialen Normen des jeweiligen Landes sowie die bestehenden Rechtsvorschriften für ähnliche Bereiche der Forschung und Medizin wider. Wenn IVG-Technologien wissenschaftlich realisierbar werden, müssen die Rechtsvorschriften geändert werden, um eine klinische Anwendung zu ermöglichen. Jede Reform der Rechtsvorschriften wird wahrscheinlich von der Meinung der Bevölkerung zu IVG und Reproduktionstechnologien beeinflusst werden, insbesondere davon, wie wichtige ethische Fragen geklärt werden, z. B. wer diese Technologien nutzen darf, wie ein gerechter Zugang zu den Technologien gewährleistet wird und, was ganz wichtig ist, welche Unterstützungsmaßnahmen getroffen werden, um die Gesundheit der daraus entstehenden Kinder langfristig angemessen zu überwachen.
Könnten wir in einer Petrischale Eizellen aus männlichen Stammzellen oder Spermien aus weiblichen Stammzellen herstellen?
Derzeit gibt es beim Menschen keine Hinweise darauf, dass IVG zur Herstellung von Spermien aus weiblichen Stammzellen oder Eizellen aus männlichen Stammzellen verwendet werden könnte. Es gibt jedoch einige Mausversuche, die Hinweise darauf liefern, dass dies möglich sein könnte.
Welche Beweise sprechen für oder gegen diese Möglichkeit?
Beweise für die Herstellung von Eizellen aus XY (männlichen) pluripotenten Stammzellen oder Spermien aus XX (weiblichen) pluripotenten Stammzellen:
Im Jahr 2018 schufen Li und Kollegen lebende Mäuse mit zwei Müttern (bimaternal) und lebende Mäuse mit zwei Vätern (bipaternal). Die bipaternalen Mäuse waren jedoch langfristig nicht lebensfähig, da sie kurz nach der Geburt starben.
Im Jahr 2023 gelang es Murakami und Kollegen, XY (männliche) Stammzellen in XX (weibliche) Stammzellen umzuwandeln. Diese XY- zu XX-Stammzellen produzierten anschließend reife und funktionsfähige Eizellen mit derselben Effizienz wie natürliche XX-Stammzellen. Nach der Befruchtung brachten diese Eizellen lebende Nachkommen hervor, was einen Beweis für die bipaternalen Fortpflanzung bei Mäusen liefert.
Beweise gegen die Produktion von Eizellen aus XY- (männlichen) Zellen oder Spermien aus XX- (weiblichen) Zellen:
Während die Veröffentlichung von Murakami und Kollegen aus dem Jahr 2023 darauf hindeutet, dass dies möglich sein könnte, wurde in jahrzehntelanger Forschung zur Gametenbildung und Geschlechtsauswahl bei Säugetieren bezweifelt, dass es möglich ist, Eizellen aus Zellen mit XY-Chromosomen oder Spermien aus Zellen ohne diese Chromosomen zu bilden (zusammengefasst in Taketo 2015). Diese früheren Studien argumentieren, dass die Produktion von Spermien aus XX (weiblichen) Zellen oder Eizellen aus XY (männlichen) Zellen nicht möglich ist. Darüber hinaus wird die Barriere für die Entwicklung gesunder Individuen in menschlichen Geschlechtschromosomenaneuploidien gesehen, die mit Sterilität verbunden sind, darunter:
- XY-Frauen – Swyer-Syndrom
- XX-Männer – De-la-Chapelle-Syndrom
- XXY-Männer – Klinefelter-Syndrom
- XO-Frauen – Turner-Syndrom
Es ist wichtig zu beachten, dass die meisten dieser Studien Bedingungen untersuchen, unter denen sowohl die Eizellen oder Spermien als auch die unterstützende Umgebung der Eierstöcke oder Hoden genetische Funktionsstörungen aufweisen. Experimente, bei denen gesunde XY-PGCs in einen gesunden XX-Eierstock oder gesunde XX-PGCs in einen gesunden XY-Hoden eingebracht wurden, wurden bisher noch nicht durchgeführt. Diese Experimente wären jedoch mit den oben beschriebenen Hayashi-Methoden theoretisch möglich.
Es sind weitere Untersuchungen erforderlich, um festzustellen, ob die Arbeit von Murakami und Kollegen zuverlässig wiederholt werden kann.
