Nessun farmaco può essere legalmente commercializzato nell'Unione Europea senza autorizzazione all'immissione in commercio. Per i Medicinali per Terapie Avanzate (MTA), il percorso standard di autorizzazione all'immissione in commercio è il processo di approvazione denominato ‘procedura centralizzata’.
Tuttavia, esistono anche tre procedure legali aggiuntive per accelerare l'accesso al mercato per i prodotti soggetti ad autorizzazione centralizzata, nonché programmi normativi istituiti dall'Agenzia Europea per i Medicinali (EMA) per accelerare l'accesso ai farmaci in Europa, assistendo nei processi di ricerca e sviluppo.
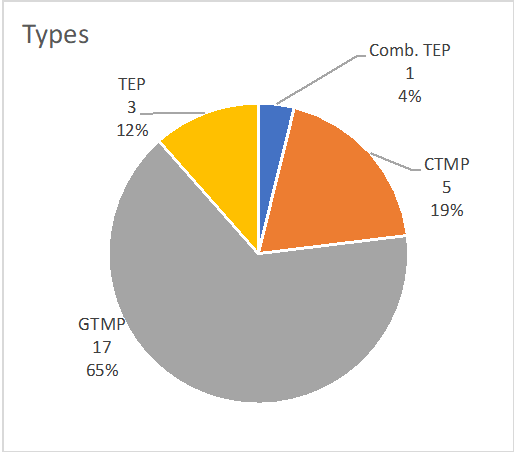
La suddivisione dei tipi di MTA autorizzati nell'UE è la seguente: 17 GTMP (65%), 5 CTMP (19%), 3 TEP (12%), 1 Comb. TEP (4%) ; Abbreviazioni: Comb. TEP: Prodotto Combinato Ingegnerizzato Tissutale, GTMP: Prodotto Medicinale per Terapia Genica, CTMP: Prodotto Medicinale per Terapia Cellulare, TEP: Prodotto Ingegnerizzato Tissutale
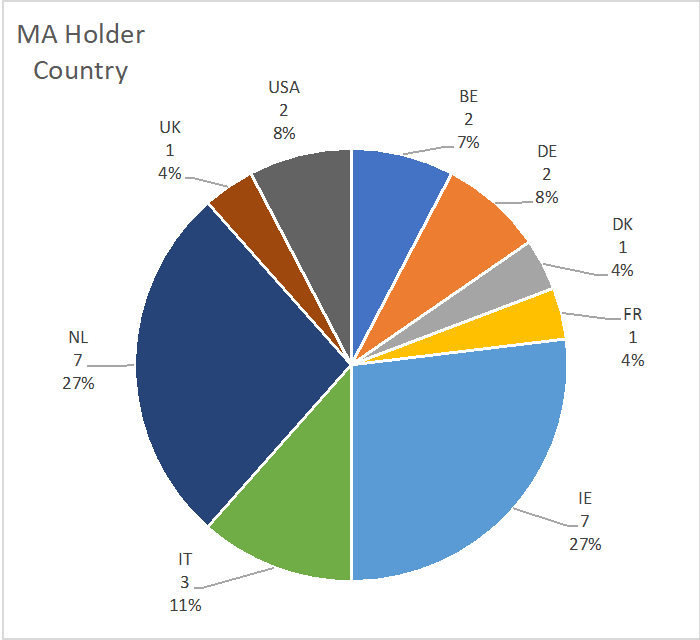
La suddivisione del paese dei detentori di MA degli MTA è la seguente: NL 7 (27%), IE 7 (27%), BE 2 (7%), DE 2 (8%), IT 3 (8%), UK 2 (11%), USA 2 (8%), DK 1 (4%) ; Abbreviazioni: BE: Belgio, DE: Germania, DK: Danimarca, IE: Irlanda, IT: Italia, NL: Paesi Bassi, UK: Regno Unito, USA: Stati Uniti d'America