La classificazione delle terapie determina i meccanismi giuridici che regolano la disciplina delle terapie geniche e cellulari, al fine di garantire la qualità, la sicurezza e l'efficacia di tali terapie sul mercato dell'Unione Europea.
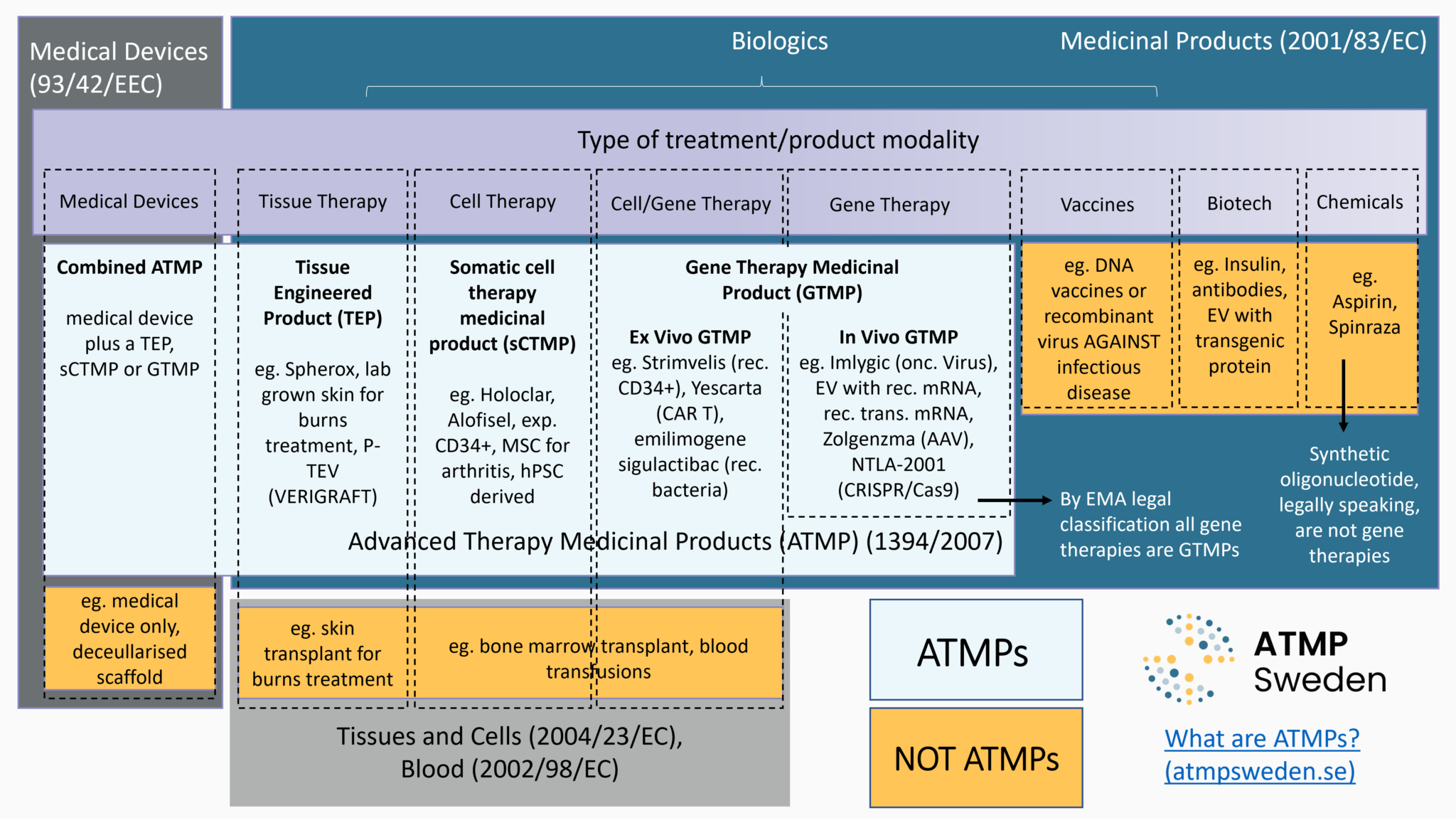
Il primo passo riguardo agli aspetti regolatori nello sviluppo delle terapie è definire il prodotto in fase di sviluppo, ossia la sua classificazione giuridica. Si tratta di un medicinale, di un dispositivo medico o di cellule o tessuti utilizzati per scopi terapeutici? Se si tratta di un medicinale, è un medicinale per terapie avanzate (MTA), un medicinale orfano e/o un medicinale per uso pediatrico? La classificazione giuridica determina il quadro regolatorio applicabile, ossia i conseguenti requisiti che il prodotto deve soddisfare e le relative procedure che portano alla commercializzazione, come l'autorizzazione all’immissione in commercio (AIC) per i medicinali per terapie avanzate (MTA). Vedere anche: Commercializzazione.
La legge (principalmente la normativa dell'Unione Europea, ma anche le leggi nazionali) fornisce definizioni legali per ciascun tipo di questi prodotti. Sono stati stabiliti diversi criteri per distinguere quale tipo di terapia genica e cellulare si sta sviluppando e, di conseguenza, quale insieme di regole si applica sia per l'accesso al mercato che per le decisioni sul rimborso. I principali criteri sono:
- La scala di sviluppo del prodotto:
- Il prodotto è sviluppato a livello "industriale" o meno?
- I gradi di manipolazione dei tessuti e delle cellule:
- I tessuti e le cellule sono stati manipolati in modo sostanziale o meno?
- I tessuti e le cellule sono utilizzati per le stesse funzioni essenziali nel ricevente come nel donatore?
Nonostante queste definizioni legali e criteri, rimane difficile sapere esattamente che tipo di terapia genica e cellulare viene sviluppata secondo la legge. Si raccomanda agli sviluppatori di contattare gli enti regolatori a livello nazionale o europeo e gli organismi di rimborso il prima possibile.
Il Comitato delle Terapie Avanzate (CAT) dell'Agenzia Europea per i Medicinali (EMA) è particolarmente coinvolto nella classificazione giuridica dei medicinali per terapie avanzate (MTA) nell'Unione Europea. In conformità con il regolamento UE (CE) n. 1394/2007 sugli MTA, l'EMA ha istituito la procedura di classificazione degli MTA per aiutare gli sviluppatori a chiarire se il loro prodotto sia un MTA o meno, e quale sia il quadro regolatorio applicabile. Il CAT dell'EMA emette raccomandazioni scientifiche basate sul fatto che il prodotto in questione soddisfi i criteri scientifici che definiscono gli MTA. Questi resoconti riassuntivi per gli MTA classificati con motivazioni sono pubblicati nelle sintesi delle raccomandazioni scientifiche dell'EMA.
Gli MTA sono una tipologia di terapia genica e cellulare, il cui sviluppo è particolarmente supportato dalla normativa dell'Unione Europea per gli obiettivi sia di salute pubblica (elevato livello di salute umana nell'UE) che economici (mercato interno e competitività). Esistono diversi percorsi regolatori per i pazienti per accedere alla terapia genica e cellulare, inclusi gli MTA. Gli MTA rientrano nel quadro normativo dei medicinali, in particolare dei medicinali biologici. Questo comprende quattro tipologie di medicinali basati su geni, cellule o tessuti: medicinale per terapia genica (MTG), medicinale per terapia con cellule somatiche (MTCS), prodotto tessutale ingegnerizzato (PTI)e MTA combinato. Secondo la normativa UE:
- Il medicinale per terapia genica (MTG) ha due caratteristiche distintive: “a) contiene una sostanza attiva che contiene o consiste di un acido nucleico ricombinante usato su o somministrato agli esseri umani al fine di regolare, riparare, sostituire, aggiungere o eliminare una sequenza genetica; b) il suo effetto terapeutico, profilattico o diagnostico è direttamente collegato alla sequenza di acido nucleico ricombinante che contiene o al prodotto dell'espressione genetica di tale sequenza. I medicinali di terapia genica non comprendono i vaccini contro le malattie infettive.” [Direttiva 2001/83/CE, Allegato I, Parte IV, come modificata dalla Direttiva della Commissione 2009/120/CE]
- I medicinale per la terapia con cellule somatiche (MTCs) è definito come un prodotto che “a) contiene o consiste di cellule o tessuti che sono stati sottoposti a una manipolazione sostanziale tale da aver alterato le caratteristiche biologiche, le funzioni fisiologiche o le proprietà strutturali in riferimento all'uso clinico proposto, oppure contiene o consiste di cellule o tessuti che non sono destinati a essere usati per le stesse funzioni essenziali nel ricevente e nel donatore; b) è presentato come atto a oppure è usato sugli esseri umani o è loro somministrato al fine di trattare, prevenire o diagnosticare una malattia mediante l'azione farmacologica, immunologica o metabolica delle sue cellule o dei suoi tessuti, ” [Direttiva 2001/83/CE, Allegato I, Parte IV, come modificata dalla Direttiva della Commissione 2009/120/CE]
- Nota: L'Allegato I del Regolamento (CE) n. 1394/2007 sugli MTA ha elencato una lista non esaustiva di manipolazioni non sostanziali: “taglio, macinazione, sagomatura, centrifugazione, immersione in soluzioni antibiotiche o antimicrobiche, sterilizzazione, irradiazione, separazione cellulare, concentrazione cellulare o purificazione cellulare, filtraggio, liofilizzazione, congelamento, crioconservazione, vetrificazione..”
- Il prodotto tessutale ingegnerizzato (PTI) “contiene o consiste di cellule o tessuti ingegnerizzatied è presentato come avente proprietà atte a o utilizzato o somministrato agli esseri umani al fine di rigenerare, riparare o sostituire un tessuto umano oppure viene utilizzato o somministrato ad esseri umani a tal fine.” [Articolo 2(1)(b) del Regolamento (CE) n° 1394/2007]
- Il medicinale per terapia avanzata combinato è un medicinale per terapia genica, o per la terapia con cellule somatiche o un prodotto tessutaleingegnerizzato associato a un dispositivo medico. Deve “incorporare, come parte integrante del prodotto, uno o più dispositivi medici o uno o più dispositivi medici attivi impiantabili; o la sua parte cellulare o tessutale deve contenere cellule o tessuti vitali, o la sua parte cellulare o tessutale che contiene cellule o tessuti non vitali deve essere suscettibile di agire sul corpo umano con un’azione che possa considerarsi primaria rispetto a quella dei dispositivi in questione.” [Articolo 2(1)(d) del Regolamento (CE) n° 1394/2007]
In questa sezione, forniremo informazioni riguardo alle diverse classificazioni legali della terapia genica e cellulare e ai conseguenti percorsi verso la clinica.
Ringraziamenti
Pubblicazione: 29/01/2022
Ultimo aggiornamento: 24/05/2025
Autore:
Hsin-Yu Kuo, EuroGCT Project Manager - Research Information and Networks
Revisione:
Aurélie Mahalatchimy, Responsabile EuroGCT del Work Package 4, UMR 7318 DICE CERIC, Aix-Marseille Università, CNRS, Aix-en-Provence, Francia
Traduzione dall'inglese all'italiano nel maggio 2025:
Victoria Burakova-Lorgnier, Giurista, UMR 7318 DICE CERIC, Aix-Marseille Università, Aix-en-Provence, Francia
Emanuele Cesta, Avvocato, funzionario legale dell’Agenzia Italiana del Farmaco – AIFA e Chair del European Committee on Pharmaceuticals and Pharmaceutical Care (CD-P-PH), EDQM, Roma, Italia