In base all’effetto da valutare, alle caratteristiche del prodotto da testare e ai criteri scelti per la valutazione, possono essere utilizzati diversi tipi di modelli.
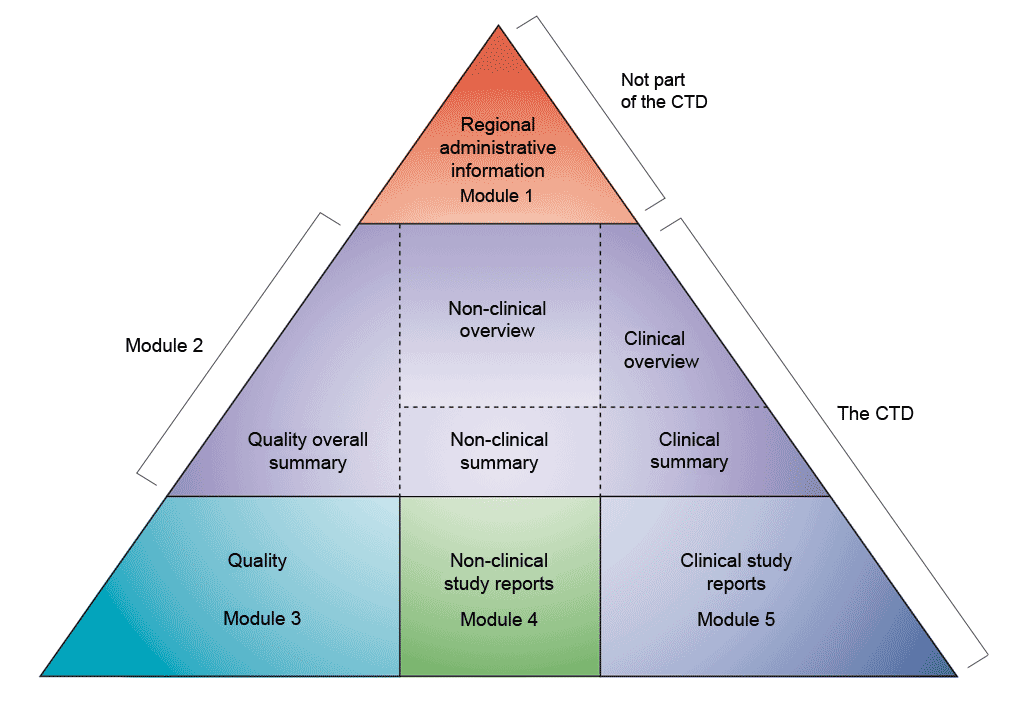
I modelli non clinici o preclinici possono essere distinti in base al loro livello di complessità, riproducendo le funzioni di una singola cellula, di un tessuto, di un organo o dell’intero organismo umano (stimato contenere circa 30–40 mila miliardi di cellule). Si veda la figura 3.
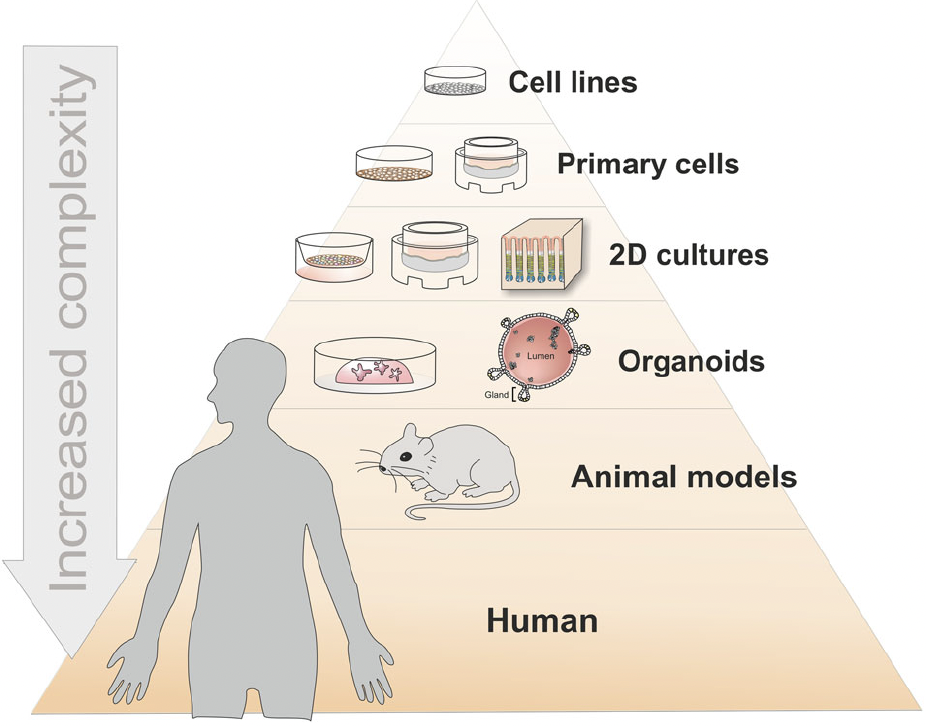
Figura 3: Complessità dei modelli viventi attualmente disponibili per studi non clinici
Organoids as host models for infection biology – a review of methods, Aguilar et al. Experimental & Molecular Medicine (2021) 53:1471–1482
Le singole cellule sono pratiche da utilizzare, ma mancano della struttura multicellulare. Gli organoidi colmano il divario tra cellule monotipo e organismi complessi. Il termine “organoide” è stato storicamente utilizzato per descrivere caratteristiche istologiche di tumori o altri tessuti, e generalmente significava “simile a un organo”. I dispositivi organ-on-chip possono ricreare il flusso vascolare, le interazioni tra tessuti e i movimenti meccanici rilevanti per l’organo. I modelli animali riproducono la complessità di organismi come i mammiferi, senza però mimare perfettamente la fisiologia umana.
- I modelli in vitro comprendono cellule umane in coltura liquida, su feeder cells (2D), in organoidi (3D) o su chip
Le cellule primarie e le linee cellulari sono utilizzate in coltura liquida per condurre studi preclinici, quali saggi di biochimica, biologia cellulare e immunologia. Le colture su cellule feeder traggono vantaggio dai fattori di crescita e dalle interazioni con lo strato di supporto, che favoriscono la proliferazione e la differenziazione delle cellule di interesse per gli studi preclinici.
Gli organoidi sono modelli 3D in miniatura che riproducono organi o tessuti, consentendo ai ricercatori di studiare le cause delle malattie e di testare nuovi trattamenti. Ad esempio, organoidi cerebrali possono essere utilizzati per valutare terapie cellulari (Brain Organoids to Evaluate Cellular Therapies, García-Delgado AB, Campos-Cuerva R, Rosell-Valle C, Martin-López M, Casado C, Ferrari D, Márquez-Rivas J, Sánchez-Pernaute R, Fernández-Muñoz B. Brain Organoids to Evaluate Cellular Therapies. Animals (Basel). 2022 Nov 15;12(22):3150) oppure modelli di organoidi possono servire a valutare immunoterapie oncologiche (Breakthroughs and challenges of organoid models for assessing cancer immunotherapy: a cutting-edge tool for advancing personalised treatments, Wang, Q., Yuan, F., Zuo, X. et al. Breakthroughs and challenges of organoid models for assessing cancer immunotherapy: a cutting-edge tool for advancing personalised treatments. Cell Death Discov. 11, 222 (2025)). Si veda la figura 4.
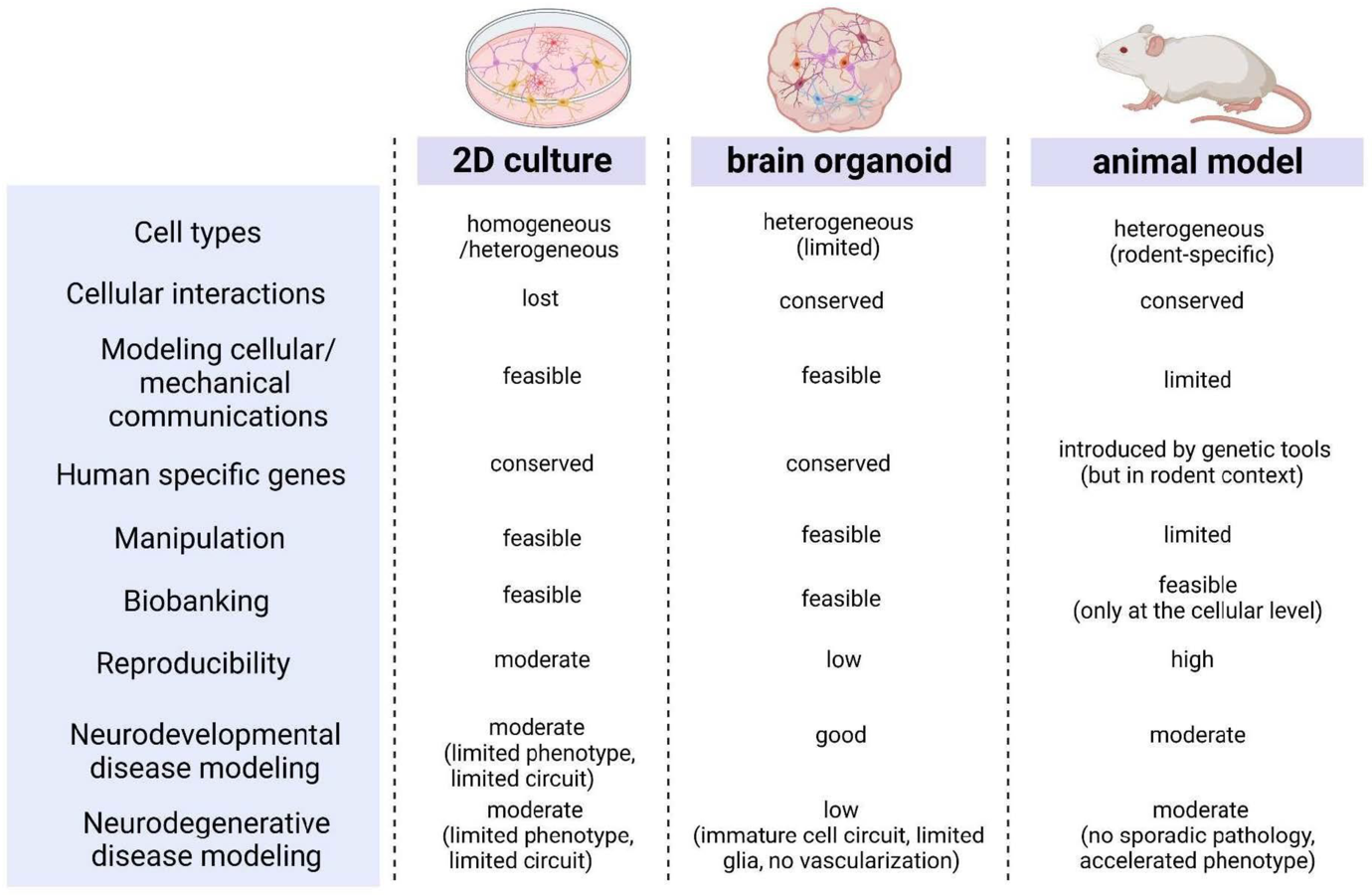
Figura 4: Colture cellulari bidimensionali (2D) e modelli tridimensionali (3D) di organoidi cerebrali. Int. J. Mol. Sci. 2023, 24, 12528. Application of Human Brain Organoids—Opportunities and Challenges in Modeling Human Brain Development and Neurodevelopmental Diseases.
Il confronto tra le caratteristiche delle colture cellulari bidimensionali (2D), dei modelli tridimensionali (3D) di organoidi cerebrali e dei modelli animali evidenzia come gli organoidi cerebrali rappresentino valide alternative ai modelli animali o ai sistemi di coltura 2D classici. Essi assumono un ruolo significativo come modelli per lo studio dei disturbi dello sviluppo cerebrale.
Le cellule su chip mirano a miniaturizzare e completare i saggi all’interno di sistemi lab-on-a-chip, consentendo il controllo delle condizioni di coltura e la misurazione di biomarcatori, come ad esempio nel caso di pancreas-on-chip.
Organoids as preclinical models of human disease: progress and applications, Chen B, Du C, Wang M, Guo J, Liu X. Organoids as preclinical models of human disease: progress and applications. Med Rev (2021). 2024 Mar 14;4(2):129-153.
Pancreatic islet organoids-on-a-chip: how far have we gone?, Yin J, Meng H, Lin J, Ji W, Xu T, Liu H. Pancreatic islet organoids-on-a-chip: how far have we gone? J Nanobiotechnology. 2022 Jun 28;20(1):308.
- Modelli ex vivo quali organi perfusi o organ-on-chip
Gli organi perfusi ex vivo offrono un’eccellente piattaforma sperimentale per lo studio della fisiologia d’organo e per testare nuovi trattamenti.
Ex-Vivo Human-Sized Organ Machine Perfusion: A Systematic Review on the Added Value of Medical Imaging for Organ Condition Assessment, Van Der Hoek JL, Krommendijk ME, Manohar S, Arens J and Groot Jebbink E (2024).
Gli organs-on-chips sono sistemi contenenti tessuti miniaturizzati, ingegnerizzati o naturali, coltivati all’interno di chip microfluidici. Per mimare meglio la fisiologia umana, i chip sono progettati per controllare il microambiente cellulare e mantenere le funzioni specifiche dei tessuti.
A guide to the organ-on-a-chip, Leung, C.M., de Haan, P., Ronaldson-Bouchard, K. et al. Nat Rev Methods Primers 2, 33 (2022).
- Modelli in vivo quali modelli animali che riproducono condizioni patologiche umane
I modelli animali che riproducono condizioni patologiche umane sono molto utili nella fase preclinica prima di intraprendere una sperimentazione clinica. Nella terapia genica, ad esempio, sono utili per valutare variabili legate all’uso di vettori virali, come sicurezza, efficacia, dosaggio e localizzazione dell’espressione del transgene.
Contemporary Animal Models For Human Gene Therapy Applications, Gopinath C, Nathar TJ, Ghosh A, Hickstein DD, Nelson EJR. Curr Gene Ther. 2015;15(6):531-40.
I piccoli animali, come i topi, sono spesso utilizzati per sviluppare terapie avanzate in ambito ematologico o immunologico, ad esempio per lo sviluppo di immunoterapie cellulari come le cellule T CAR. Vengono generati topi transgenici per creare modelli di malattie umane. I modelli murini immunodeficienti e umanizzati sono generati per testare cellule umane in studi xenogenici.
Le terapie cellulari basate su cellule staminali ematopoietiche umane (terapie per Immunodeficienza Combinata Grave da Deficit di Adenosina Deaminasi – ADA-SCID, talassemia transfusione-dipendente – TDT, Leucodistrofia Metacromatica – MLD, Anemia Falciforme – SCD …) o su cellule del sistema immunitario (terapie per Mieloma Multiplo – MM, Leucemia Acuta Linfoblastica B – B-ALL, Leucemia Acuta Mieloide – AML …) sono spesso testate in topi immunodeficienti (topi nudi, topi SCID, topi NOD SCID, topi NSG, topi NOG, topi BRGSF, topi NCG, ecc.) oppure in modelli murini umanizzati (solitamente generati per riprodurre meglio lo sviluppo dell’immunità innata e adattativa umana) prima di essere valutate negli studi clinici.
Gli animali di taglia maggiore, come cani o primati non umani, sono utilizzati per studi preclinici su muscoli e sistema nervoso centrale, ad esempio per testare vettori Virus Adeno-Associati (AAV) destinati al trattamento di miopatie o malattie neurodegenerative.
I modelli in silico sono sviluppati da programmatori e data scientist e costruiti utilizzando set di dati reali, quali dati clinici, genomici, proteomici, trascrittomici, ecc. Algoritmi di intelligenza artificiale sono spesso impiegati per navigare tra grandi set di dati e interagire con utenti finali come ricercatori di laboratorio e clinici.
In silico regenerative medicine: how computational tools allow regulatory and financial challenges to be addressed in a volatile market, Geris L, Guyot Y, Schrooten J, Papantoniou I. Interface Focus. 2016 Apr 6;6(2):20150105.
I modelli in silico più avanzati mirano a diventare gemelli digitali dei pazienti e a essere utilizzati per accelerare la selezione dei candidati farmaceutici e lo sviluppo di medicinali. Si veda la figura 5.

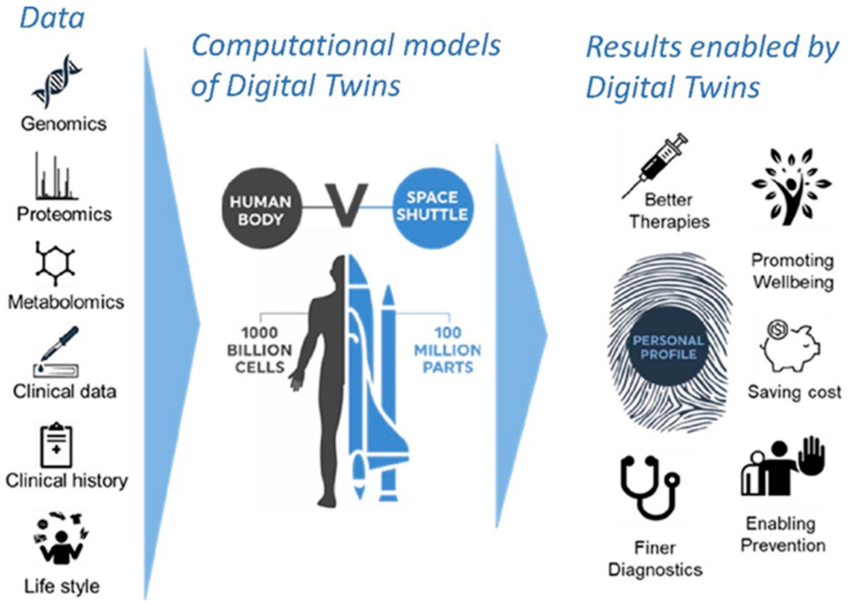
Figura 5: Il concetto di gemelli digitali
Figure adattate da Targeting MAPK Signaling in Cancer: Mechanisms of Drug Resistance and Sensitivity, Lee S, Rauch J, Kolch W. Targeting MAPK Signaling in Cancer: Mechanisms of Drug Resistance and Sensitivity. International Journal of Molecular Sciences. 2020; 21(3):1102.
L’integrazione di dati molecolari, clinici e di imaging attraverso modelli computazionali consentirà di generare gemelli digitali di tessuti, organi e pazienti. I nuovi trattamenti potrebbero essere testati prima sul gemello digitalz, permettendo di selezionare l’opzione migliore per gli studi clinici. La creazione di un gemello digitale di un paziente è estremamente complessa: se per uno shuttle spaziale si considerano 100 milioni di componenti, per il corpo umano dovrebbero essere considerate circa 1.000.000 milioni di cellule.