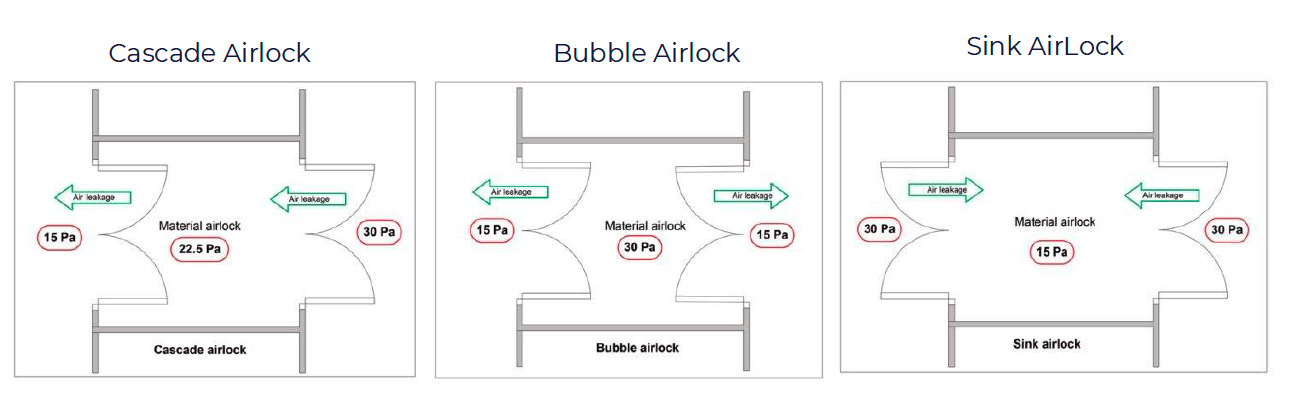
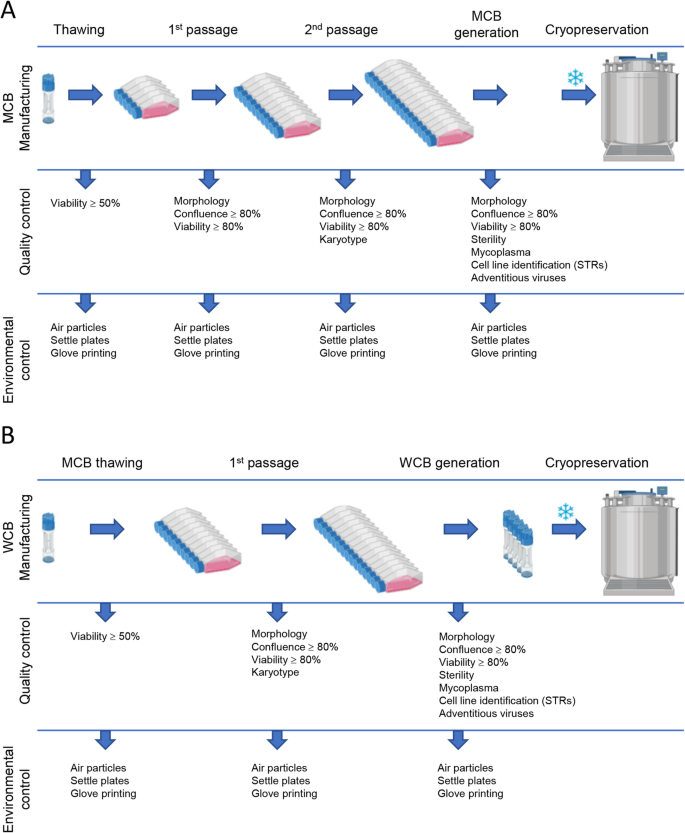
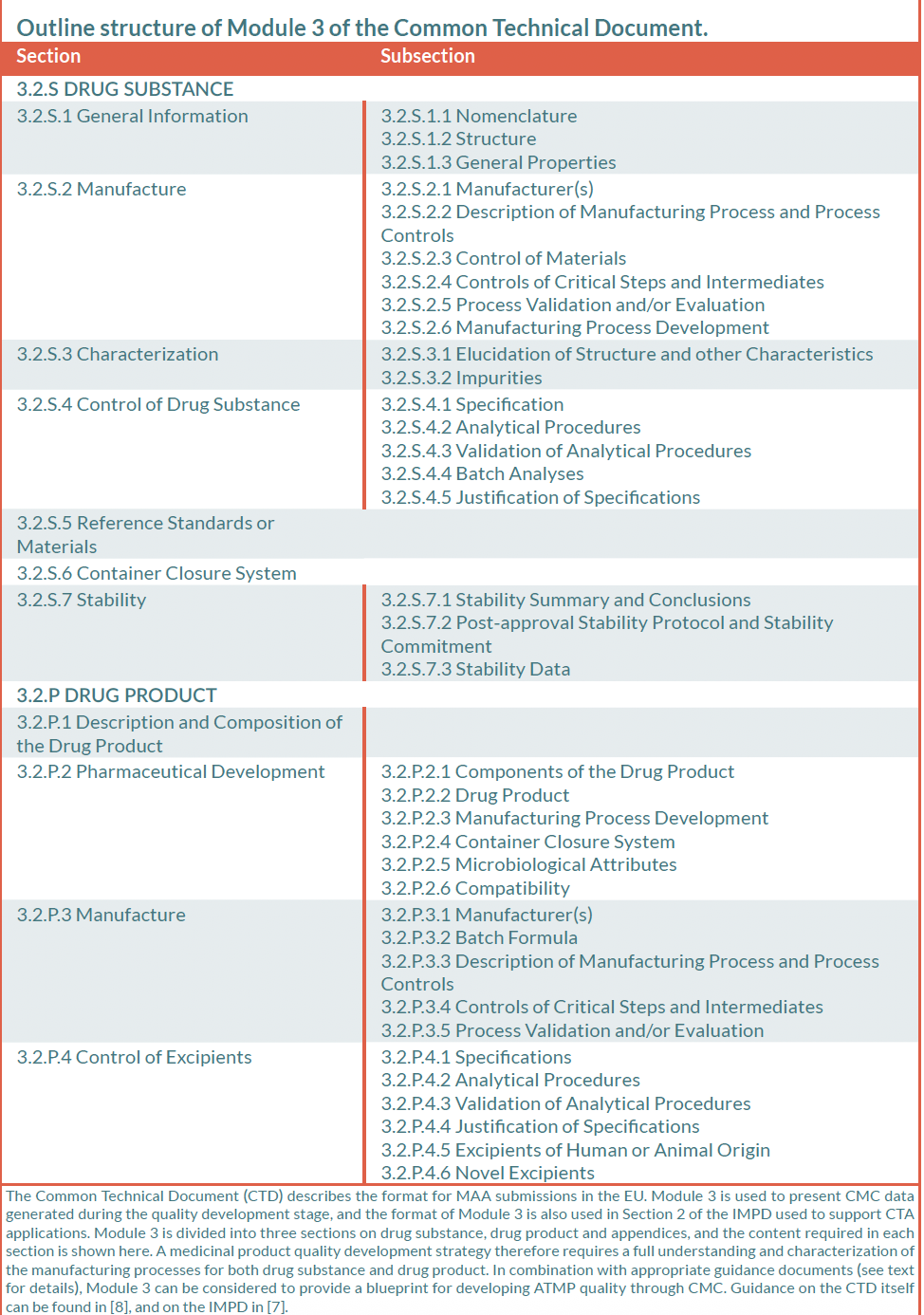
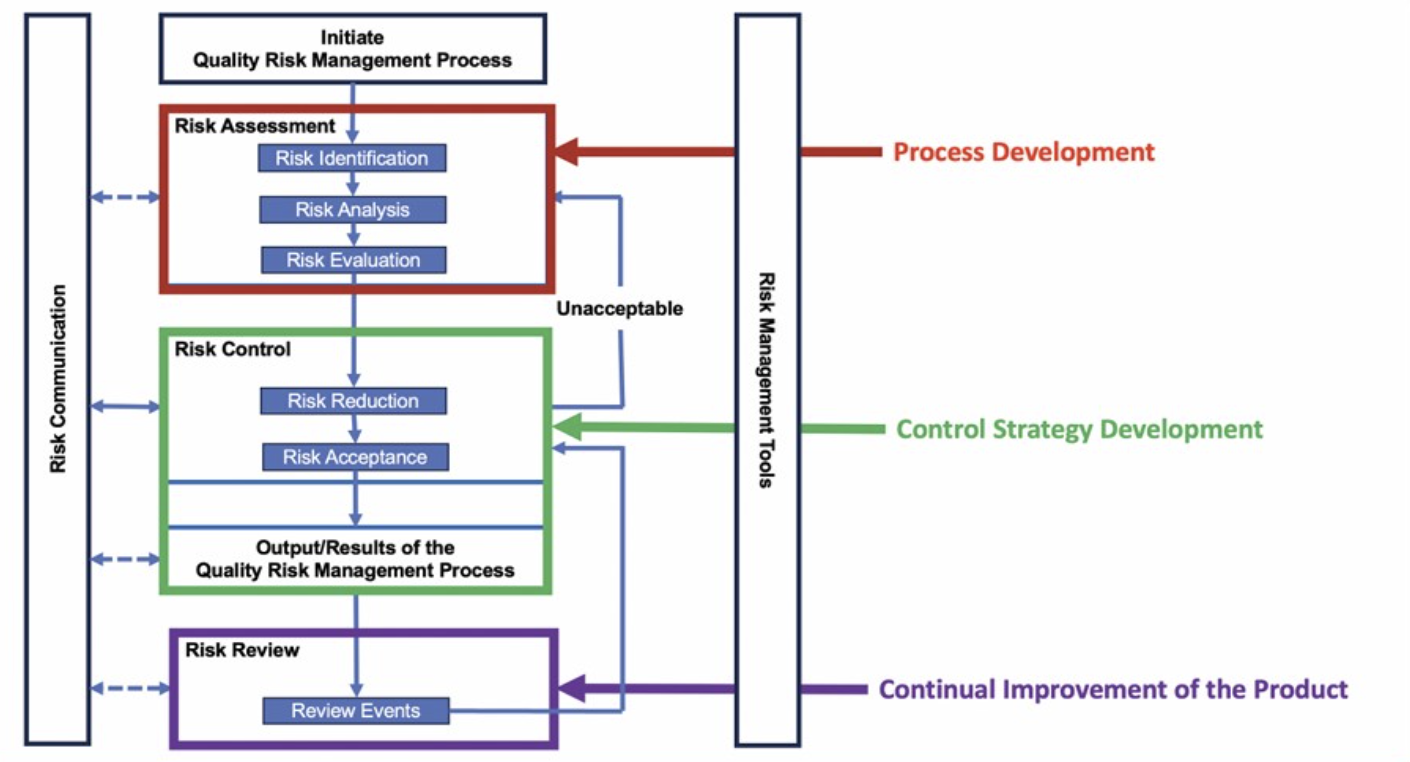
Medicinali per Terapie Avanzate (MTA)
Secondo l’Agenzia Europea per i Medicinali (EMA), i MTA sono medicinali per uso umano basati su geni, tessuti o cellule. Si tratta di medicinali per uso umano il cui principio attivo terapeutico si basa su almeno uno dei seguenti elementi: 1) tecnologia per modificare il genoma del paziente, 2) acidi nucleici ricombinanti o geni, 3) cellule sostanzialmente manipolate, 4) cellule destinate a una funzione essenziale nel paziente diversa rispetto a quella nel donatore, 5) tessuto ingegnerizzato.
I MTA offrono nuove opportunità per il trattamento di malattie e lesioni con bisogni medici insoddisfatti.
I MTA sono classificati in tre categorie principali:
- Medicinali di Terapia Genica (GTMPs),
- Medicinali per Terapia Cellulare Somatica (sCTMPs),
- Prodotti Tessutali Ingegnerizzati (TEPs).
Inoltre, i MTA combinati contengono uno o più dispositivi medici come parte integrante del medicinale (vedi “Classificazione delle terapie” su EuroGCT).
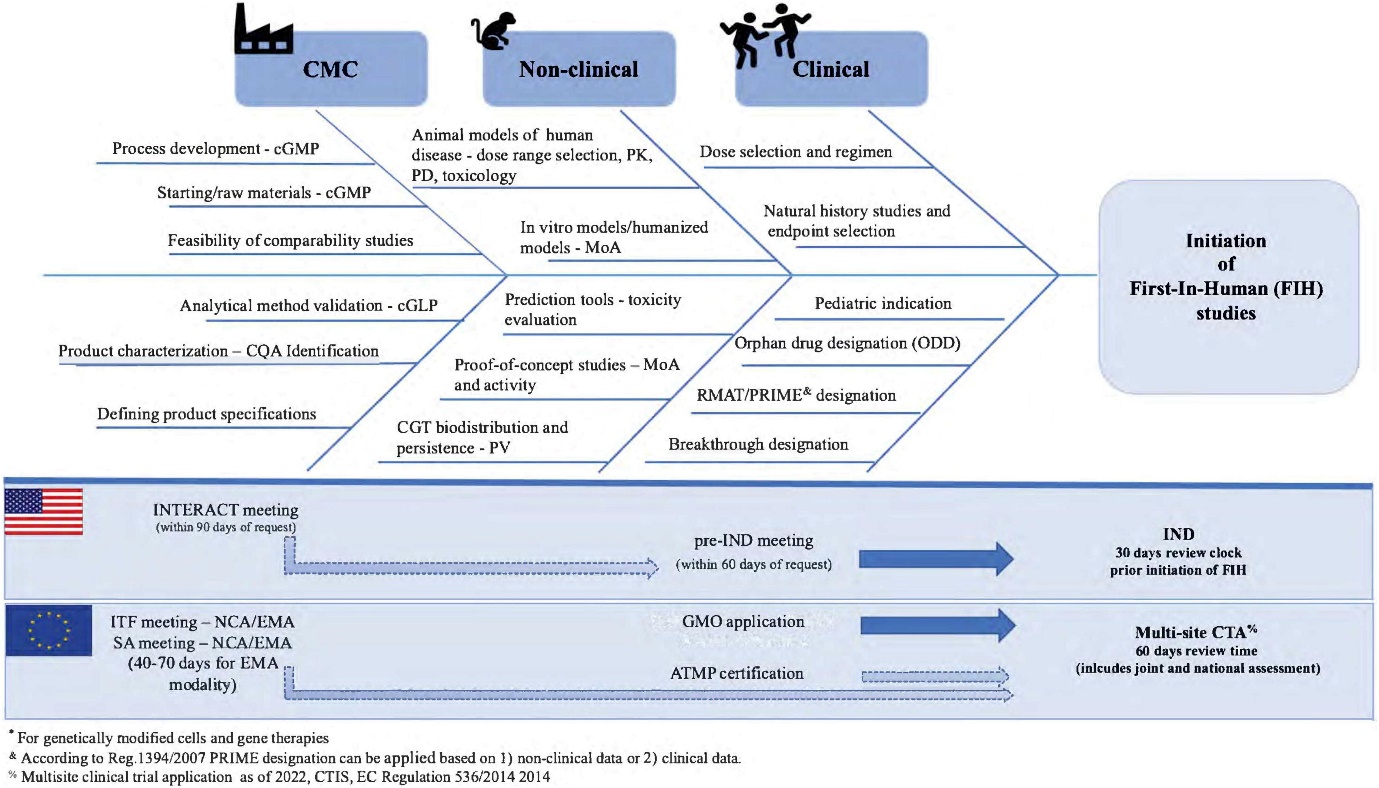
Prima che queste terapie siano somministrate ai pazienti, i prodotti devono completare una fase di sviluppo conforme alle linee guida delle autorità regolatorie, come l’EMA. All’inizio dello sviluppo del farmaco, gli sviluppatori di medicinali di terapia genica e medicinali basati su cellule devono affrontare i requisiti regolatori relativi agli studi non clinici (vedi “Non-clinical Development Flowchart” su EuroGCT).
In questa fase iniziale, gli sviluppatori devono rispondere a domande chiave quali: “qual è il meccanismo d’azione?”, “qual è l’efficacia?” e “quali sono le potenziali criticità tossicologiche?”. Nelle fasi successive dello sviluppo, devono inoltre rispettare vari standard, incluse le Buone Pratiche di Laboratorio (BPL), le Buone Pratiche di Fabbricazione (GMP) (vedi “Buone pratiche di fabbricazione per i MTA” su EuroGCT) e le Buone Pratiche Cliniche (GCP) (vedi “Clinical trials” su EuroGCT).
La valutazione della qualità, sicurezza ed efficacia dei MTA è condotta dal Comitato delle Terapie Avanzate (CAT) dell’EMA.
Il CAT fornisce raccomandazioni scientifiche sulla classificazione dei MTA (vedi “CAT raccomandazioni scientifiche sulla classificazione” su EuroGCT) ed è responsabile della redazione di un parere preliminare su ciascuna domanda di autorizzazione all’immissione in commercio di un MTA presentata all’EMA. Tale bozza è poi esaminata dal Comitato per i Medicinali per Uso Umano (CHMP), che adotta il parere finale sull’autorizzazione del medicinale (vedi “Accesso al mercato dei MTA” su EuroGCT).
Il CAT partecipa inoltre a procedure finalizzate a fornire consulenza sul monitoraggio dell’efficacia, sulla farmacovigilanza o sui sistemi di gestione del rischio per i MTA (vedi “Sostegno allo sviluppo di farmaci innovativi a livello EMA” su EuroGCT).
Ulteriori informazioni sono disponibili nel Regolamento (CE) 1394/2007 e CAT Work Plan 2025.
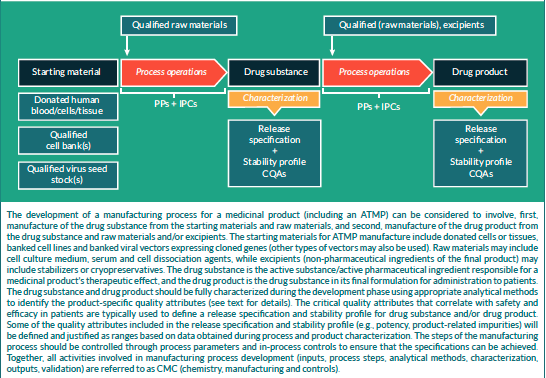
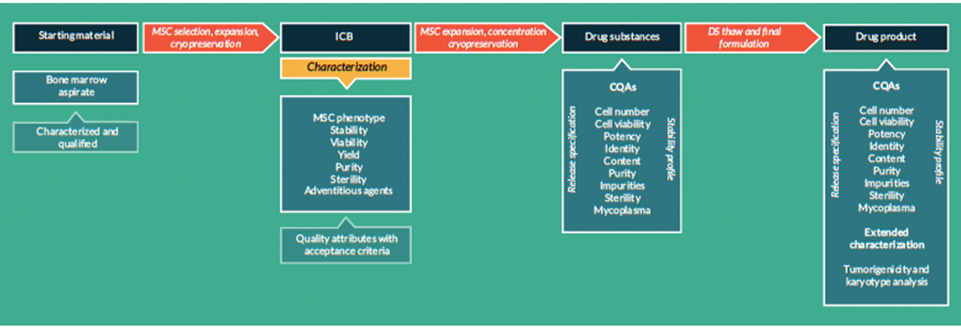
La fabbricazione e il controllo rappresentano fasi fondamentali nello sviluppo di un farmaco. Esse riguardano la produzione e la caratterizzazione della sostanza medicinale (chiamata anche drug substance, DS), che viene poi formulata per diventare il medicinale finito (drug product, DP). Questo prodotto viene rilasciato secondo criteri ben definiti e può essere conservato prima della somministrazione ai pazienti.
I termini “fabbricazione, controllo e formulazione” sono collettivamente indicati come CMC (Chemistry, Manufacturing and Control). Il CMC, insieme alle attività precliniche e cliniche, è necessario per passare dalla fase di scoperta a quella clinica. Le domande di sperimentazione clinica in Europa (vedi “Clinical trials” su EuroGCT) e le Investigational New Drug (IND) applications negli USA sono esaminate dalle autorità regolatorie e devono essere approvate prima di avviare gli studi clinici. Tali domande devono includere informazioni relative agli studi non clinici di farmacologia e tossicologia, alla fabbricazione e al controllo, ai protocolli clinici e ai dati degli sperimentatori.
La Figura 1, intitolata “CMC in drug development”, fornisce ulteriori dettagli su questo processo.
I documenti di guidance aiutano gli sviluppatori in un campo in rapida evoluzione come quello dei MTA, in cui i progressi scientifici si traducono spesso rapidamente in innovazioni terapeutiche. The mapping of the European landscape and specificity of ATMPs guidance sono state pubblicate a giugno 2025 da Aurélie Mahalatchimy et al.