En fonction de l'effet à évaluer, des caractéristiques du produit à tester et des critères choisis pour l'évaluation, différents types de modèles peuvent être utilisés.
Différents types de modèles non cliniques ou précliniques peuvent être distingués en fonction de leur niveau de complexité, qui reproduisent les fonctions d'une cellule, d'un tissu, d'un organe ou du corps humain. Le nombre total de cellules dans le corps humain est à environ 36 000 milliards pour un homme, 28 000 milliards pour une femme et 17 000 milliards pour un enfant (PMID: 37722043). Voir figure 3. De plus, 38 000 milliards de bactéries vivent dans le corps humain, principalement dans l’intestin.
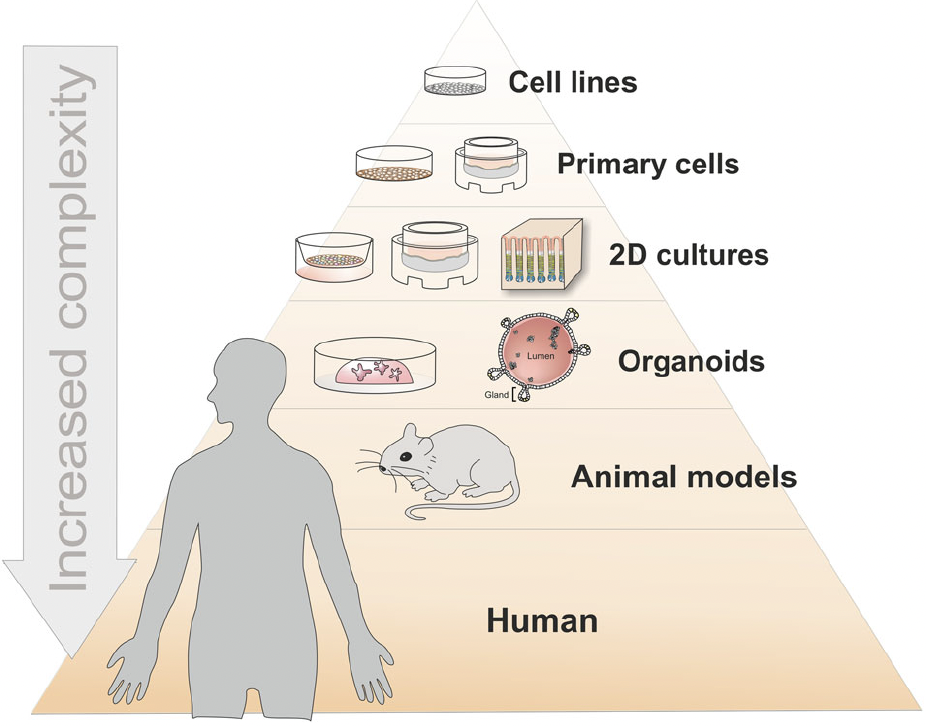
Figure 3 : Complexité des modèles vivants actuellement disponibles pour les études non cliniques
Organoids as host models for infection biology – a review of methods, Aguilar et al. Experimental & Molecular Medicine (2021) 53:1471–1482 (en anglais)
Les cellules individuelles sont pratiques à utiliser, mais elles ne possèdent pas de structure multicellulaire et donc ne représentent pas la complexité des interactions entre cellules. Les organoïdes comblent le fossé entre les cellules monotypiques et les organismes complexes. Le terme « organoïde » a été utilisé dans le passé pour décrire les caractéristiques histologiques des tumeurs ou d'autres tissus et signifiait généralement « ressemblant à un organe ». Les dispositifs « organes sur puce » peuvent reproduire le flux vasculaire, les interactions entre tissus et les mouvements mécaniques propres aux organes. Les modèles animaux reproduisent la complexité d'organismes tels que les mammifères sans imiter parfaitement la physiologie humaine.
- Modèles in vitro : cellules humaines en culture liquide, sur cellules nourricières (2D), en organoïdes (3D) ou sur puces
Les cellules primaires et les lignées cellulaires sont utilisées en culture liquide pour réaliser des études précliniques telles que des tests de biochimie, de biologie cellulaire et d'immunologie. Les cultures sur cellules nourricières bénéficient de facteurs de croissance et d'interactions avec la couche de cellules nourricières qui soutiennent la croissance et la différenciation des cellules d'intérêt pour les études précliniques.
Les organoïdes sont des modèles miniatures en 3D imitant les organes ou les tissus, permettant aux scientifiques d'étudier les causes des maladies et de tester de nouveaux traitements. Par exemple, les organoïdes cérébraux pour évaluer les thérapies cellulaires (Brain Organoids to Evaluate Cellular Therapies, García-Delgado AB, Campos-Cuerva R, Rosell-Valle C, Martin-López M, Casado C, Ferrari D, Márquez-Rivas J, Sánchez-Pernaute R, Fernández-Muñoz B. Animals (Basel). 2022 Nov 15;12(22):3150, en anglais) ou les modèles organoïdes pour évaluer l'immunothérapie du cancer (Breakthroughs and challenges of organoid models for assessing cancer immunotherapy: a cutting-edge tool for advancing personalised treatments, Wang, Q., Yuan, F., Zuo, X. et al. Cell Death Discov. 11, 222 (2025), en anglais). Voir figure 4.
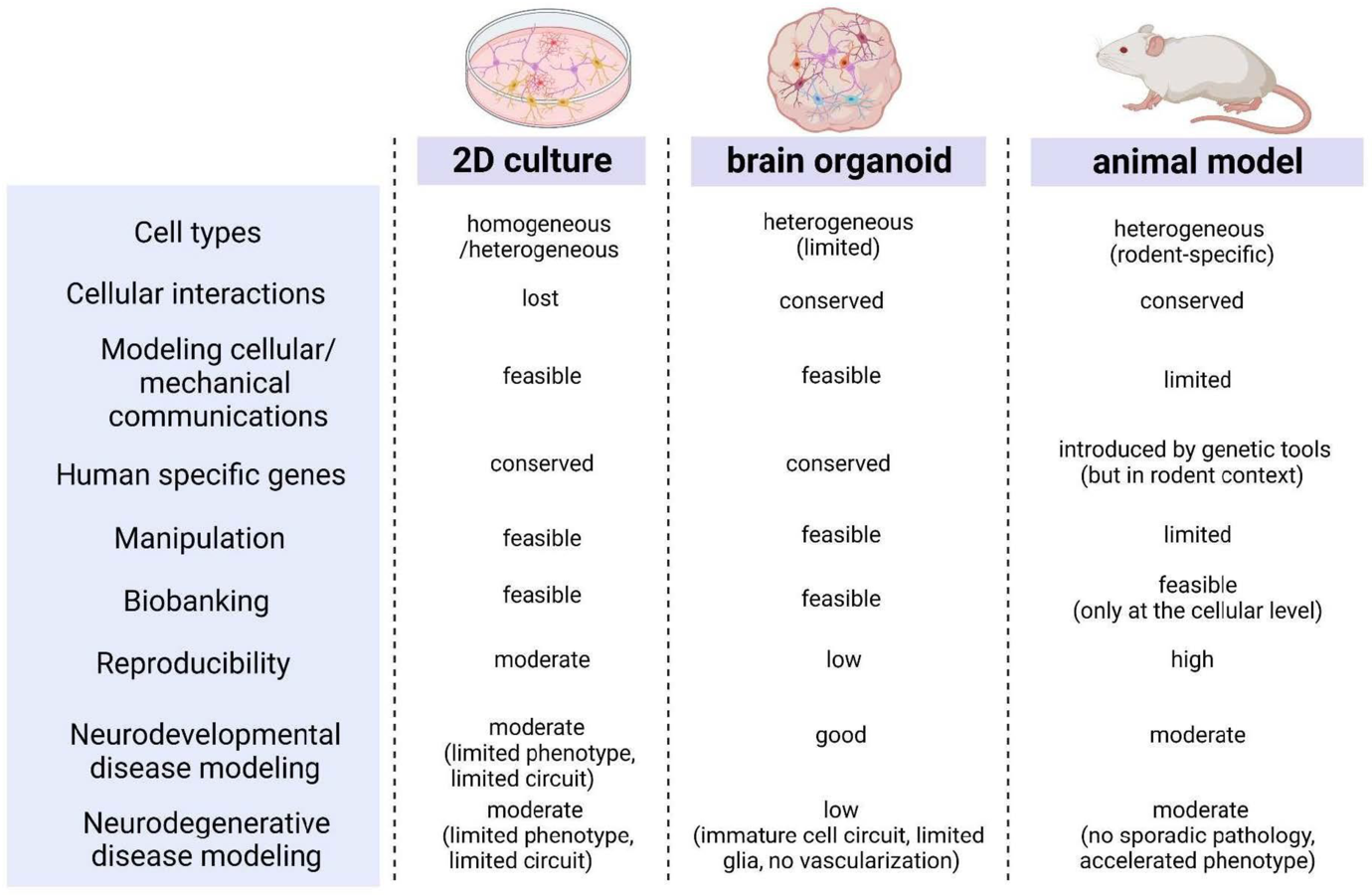
Figure 4 : Two-dimensional (2D) cell culture, three-dimensional (3D) brain organoid models. Int. J. Mol. Sci. 2023, 24, 12528. Application of Human Brain Organoids—Opportunities and Challenges in Modeling Human Brain Development and Neurodevelopmental Diseases (en anglais).
La comparaison des caractéristiques entre la culture cellulaire bidimensionnelle (2D), les modèles organoïdes cérébraux tridimensionnels (3D) et les modèles animaux permet de choisir celui qui est le mieux adapté à une étude donnée. Il doit être suffisamment simple pour être bien décrit par les paramètres du système expérimental et pertinent en vue des futures applications au corps humain. Les organoïdes cérébraux deviennent des alternatives aux modèles animaux ou aux systèmes de culture 2D classiques dans les expériences, et leur importance prend de l’ampleur en tant que modèles précieux pour l'étude des troubles du développement cérébral.
Les cellules sur puce visent à miniaturiser et compléter l’arsenal des tests de laboratoire en permettant de contrôler les conditions de culture et de mesurer des biomarqueurs (par exemple, pancréas sur puce) avec plus de précisions.
Organoids as preclinical models of human disease: progress and applications, Chen B, Du C, Wang M, Guo J, Liu X. Organoids as preclinical models of human disease: progress and applications. Med Rev (2021). 2024 Mar 14;4(2):129-153 (en anglais).
Pancreatic islet organoids-on-a-chip: how far have we gone?, Yin J, Meng H, Lin J, Ji W, Xu T, Liu H. Pancreatic islet organoids-on-a-chip: how far have we gone? J Nanobiotechnology. 2022 Jun 28;20(1):308 (en anglais).
- Modèles ex vivo tels que les organes perfusés ou les organes sur puce
Les organes perfusés ex vivo constituent une excellente plate-forme expérimentale pour étudier la physiologie des organes et tester de nouveaux traitements.
Ex-Vivo Human-Sized Organ Machine Perfusion: A Systematic Review on the Added Value of Medical Imaging for Organ Condition Assessment, Van Der Hoek JL, Krommendijk ME, Manohar S, Arens J and Groot Jebbink E (2024) (en anglais).
Les organes sur puce sont des systèmes contenant des tissus miniatures naturels ou fabriqués par ingénierie et cultivés à l'intérieur de puces microfluidiques. Pour mieux imiter la physiologie humaine, les puces sont conçues pour contrôler les microenvironnements cellulaires et maintenir les fonctions spécifiques aux tissus.
A guide to the organ-on-a-chip, Leung, C.M., de Haan, P., Ronaldson-Bouchard, K. et al. Nat Rev Methods Primers 2, 33 (2022) (en anglais).
- Modèles in vivo tels que des modèles animaux imitant les conditions pathologiques humaines
Les modèles animaux imitant des maladies humaines sont très utiles à l’étape préclinique avant de se lancer dans un essai clinique. En thérapie génique par exemple, ils sont utiles dans l’évaluation des variables liées à l’utilisation de vecteurs viraux telles que la sécurité, l’efficacité, le dosage et la localisation de l’expression de transgènes.
Contemporary Animal Models For Human Gene Therapy Applications, Gopinath C, Nathar TJ, Ghosh A, Hickstein DD, Nelson EJR. Curr Gene Ther. 2015;15(6):531-40. (en anglais)
Les petits animaux tels que les souris sont souvent utilisés pour développer des thérapies innovantes liées à l'hématologie ou à l'immunologie, par exemple pour développer des immunothérapies cellulaires telles que les cellules CAR-T. Les souris transgéniques sont générées pour créer des modèles de maladies humaines. Des modèles de souris immunodéficientes et humanisées sont générés pour tester des cellules humaines dans des études xénogéniques. Les thérapies cellulaires basées sur les cellules souches hématopoïétiques humaines (traitements pour le déficit combiné en adénosine désaminase (ADA-SCID), la thalassémie transfusionnelle (TDT), la leucodystrophie métachromatique (MLD), la drépanocytose (SCD) …) ou les cellules immunitaires (traitements pour le myélome multiple (MM), leucémie lymphoblastique aiguë à cellules B (B-ALL), la leucémie myéloïde aiguë (AML) ...), sont souvent testées sur des souris immunodéficientes (souris nues, souris SCID, souris NOD SCID, souris NSG, souris NOG, souris BRGSF, souris NCG, etc.) ou sur des modèles de souris humanisées (généralement créés pour mieux reproduire le développement de l'immunité innée et adaptative humaine) avant d'être évaluées dans le cadre d'essais cliniques. Des animaux plus grands, tels que des chiens ou des primates non humains, sont utilisés pour des études précliniques sur les muscles et le système nerveux central, par exemple pour tester des vecteurs du virus adéno-associé (AAV) afin de traiter des myopathies ou des maladies neurodégénératives.
Les modèles in silico sont développés par des programmeurs informatiques et des scientifiques spécialisés dans les données, et construits à partir d'ensembles de données réelles telles que des données cliniques, génomiques, protéomiques, transcriptomiques, etc. Des algorithmes d'intelligence artificielle sont souvent utilisés pour naviguer dans les grands ensembles de données et interagir avec les utilisateurs finaux, tels que les scientifiques de laboratoire et les cliniciens.
In silico regenerative medicine: how computational tools allow regulatory and financial challenges to be addressed in a volatile market, Geris L, Guyot Y, Schrooten J, Papantoniou I. Interface Focus. 2016 Apr 6;6(2):20150105. (en anglais)
Les modèles in silico les plus avancés visent à devenir des jumeaux numériques des patients et à être utilisés pour accélérer la sélection des candidats-médicaments et le développement des médicaments. Voir figure 5.

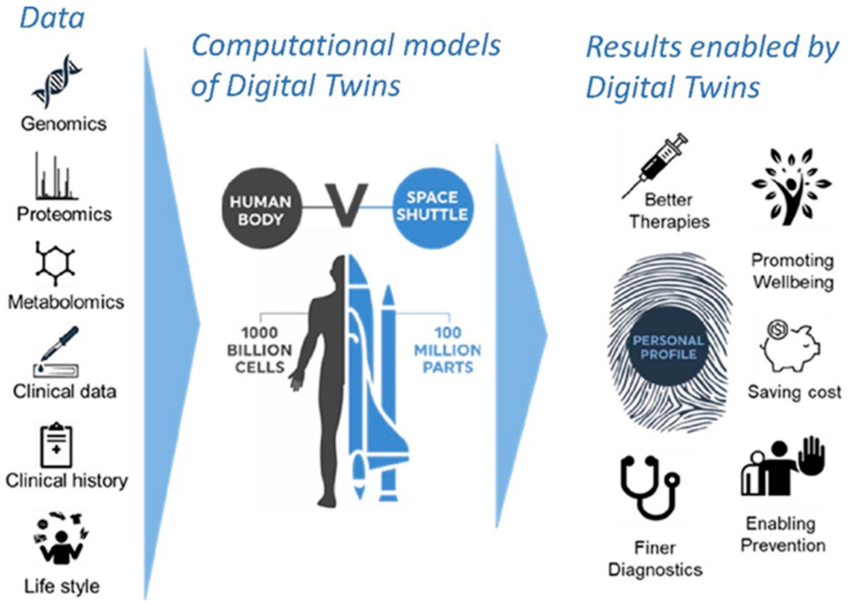
Figure 5 : Le concept de jumeaux numériques
Figures adaptées de : Targeting MAPK Signaling in Cancer: Mechanisms of Drug Resistance and Sensitivity, Lee S, Rauch J, Kolch W. Targeting MAPK Signaling in Cancer: Mechanisms of Drug Resistance and Sensitivity. International Journal of Molecular Sciences. 2020; 21(3):1102. (en anglais)
L'intégration des données moléculaires, cliniques et d'imagerie au moyen de modèles informatiques permettra de générer des jumeaux numériques des patients. De nouveaux traitements pourraient être testés pour la première fois sur le jumeau numérique et la meilleure option sélectionnée pour les essais cliniques (Targeting MAPK Signaling in Cancer: Mechanisms of Drug Resistance and Sensitivity, en anglais). La création d'un jumeau numérique d'un patient représente un véritable défi. Si 100 millions de pièces doivent être prises en compte pour la construction d’une navette spatiale, 1000 000 millions de cellules doivent l'être pour un corps humain.